한동대학교/일반화학
[일반화학] Chapter 4 -(2)
pangil_kim
2025. 3. 14. 18:28
728x90
3. Acid-Base Reactions (산과 염의 반응)
[1] Properties of Acids (산의 특성)
- 신 맛이 있다.
- 식초의 맛은 아세트산 때문이다.
- 감귤류에는 구연산이 들어 있다.
- 식물 염료의 색 변화를 일으킨다.
- 특정 금속과 반응하여 수소 가스를 생성한다.
- 탄산염 및 중탄산염과 반응하여 이산화탄소 가스를 생성한다.
- 수용성 산성 용액은 전기를 전도한다.
[2] Properties of Bases (염기의 특성)
- 쓴 맛이 있다.
- 미끄러운 느낌이 있다.
- 많은 비누에 염기가 포함되어 있다.
- 식물 염료의 색 변화를 일으킨다.
- 수용성 염기 용약은 전기를 전도한다.
[2] Arrhenius Acids and Bases (아레니우스 산과 염기)
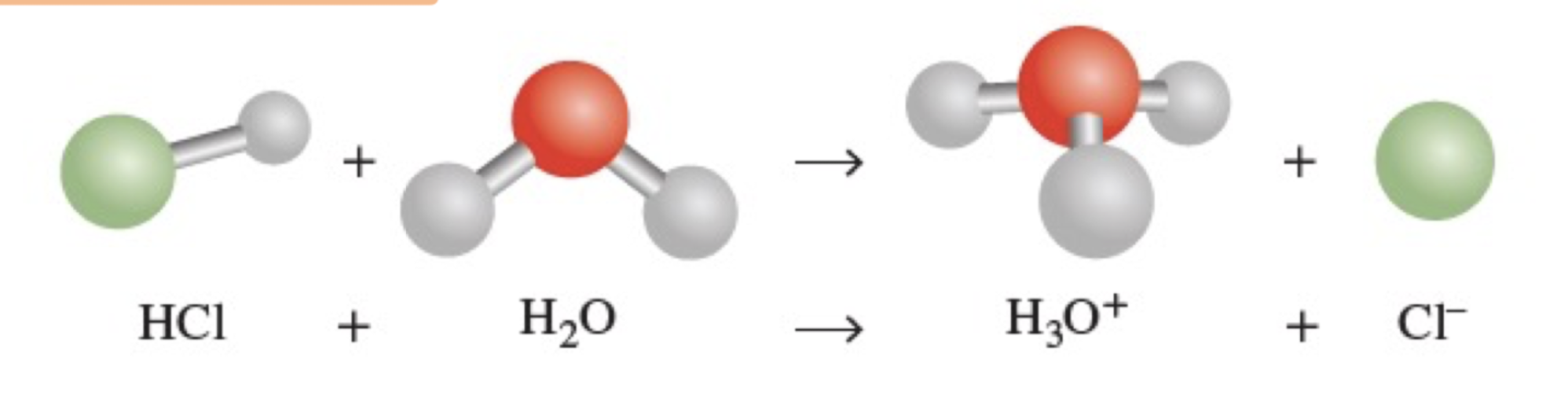
1) Arrhenius Acid
: 물에 용해될 때 수소 이온(H⁺) 또는 수화된 수소 이온(H₃O⁺)을 생성하는 물질
-> 수용액에서 산성을 나타내는 물질
2) Arrhenius Base
: 물에 용해될 때 수산화 이온(OH⁻)을 생성하는 물질
-> 수용액에서 염기성을 나타내는 물질
[3] Bronsted Acids and Bases (브론스테드 산과 염기)
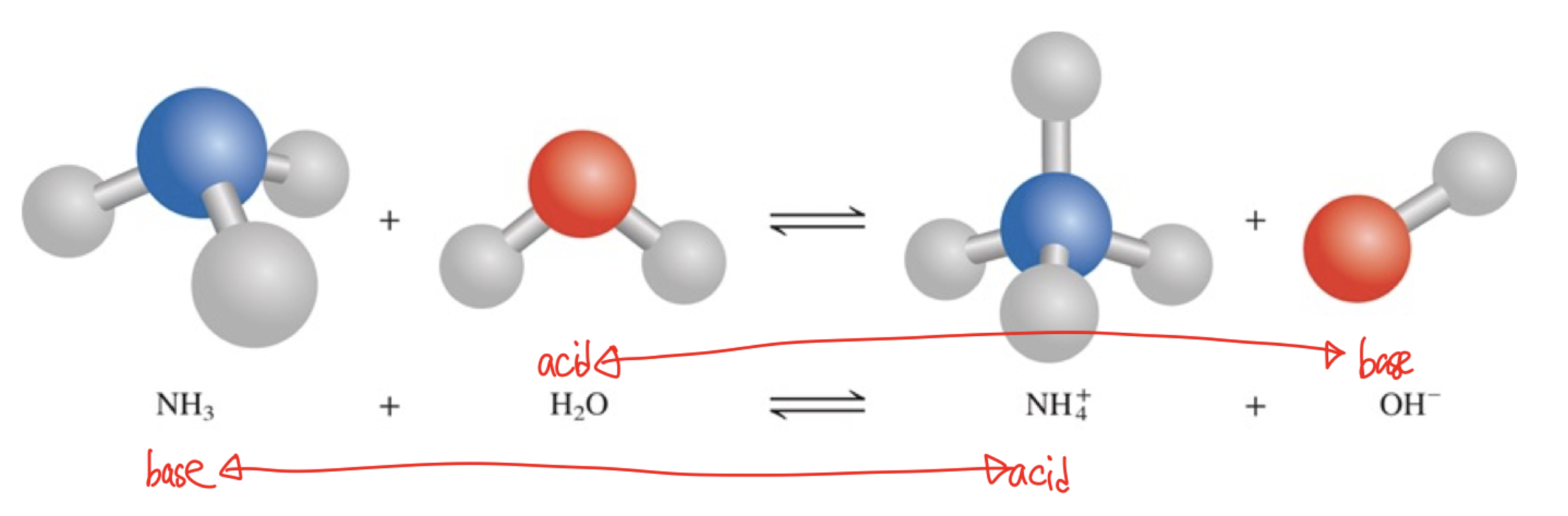
1) Bronsted Acids
: 양성자의 공여체이다. (proton donor)
: 양성자(H⁺)를 공여하는 물질이다.
-> 즉, 다른 물질에 양성자를 주어 산으로 작용한다.
- Bronsted Acids은 이온화 가능한 양성자를 하나 이상 포함해야 한다.
(이는 산이 다른 물질과 반응할 때 H⁺를 내놓을 수 있어야 한다는 것을 의미한다.)
2) Bronsted Bases
: 양성자의 수용체이다. (proton acceptor)
: 양성자를 수용하는 물질이다.
-> 즉, 다른 물질로부터 H⁺를 받아들이는 역할을 한다.
- 브론스테드 염기는 일반적으로 전자쌍을 가지고 있는 물질로, 양성자를 수용하여 새로운 화합물을 형성한다.
[4] Types of Acids (산의 종류)

[5] Common Acids (일반적인 산)
[6] Neutralization Reaction (중화 반응)
1) 형태
: acid + base => salt + water
2) 구성 요소
- 산 (Acid): H⁺ 이온을 방출하는 물질
- 예: 염산(HCl), 황산(H₂SO₄)
- 염기 (Base): OH⁻ 이온을 방출하는 물질
- 예: 수산화나트륨(NaOH), 수산화칼슘(Ca(OH)₂)
- 소금 (Salt): 중화 반응의 결과로 생성되는 이온성 화합물
- 예: NaCl (염화나트륨), KNO₃ (질산칼륨)
- 물 (Water): H₂O로 생성되는 물질
3) 반응 과정
: 중화 반응에서는 산과 염기가 서로 반응하여 H⁺와 OH⁻ 이온이 결합하여 물을 형성합니다. 이때 남은 이온들이 결합하여 소금이 형성됩니다.
[7] Neutralization Reaction Involving a Weak Electrolyte (약한 전해질과 관련된 중화 반응)
1) 형태
: weak acid + base -> salt + water
2) 2. 구성 요소
- 약한 산 (Weak Acid):
- 완전히 이온화되지 않고, 물속에서 일부만 이온화되는 산.
- 예: 아세트산 (CH₃COOH), 탄산 (H₂CO₃)
- 염기 (Base):
- OH⁻ 이온을 방출하는 물질. 강한 염기와 약한 염기가 모두 사용될 수 있습니다.
- 예: 수산화나트륨 (NaOH, 강한 염기), 암모니아 (NH₃, 약한 염기)
- 소금 (Salt):
- 중화 반응의 결과로 생성되는 이온성 화합물.
- 예: CH₃COONa (아세트산 나트륨), Na₂CO₃ (탄산 나트륨)
- 물 (Water):
- H₂O로 생성되는 물질
3) 반응 과정
: 약한 산과 염기가 반응할 때, 약한 산은 일부 이온화되어 H⁺를 방출하고, 염기는 OH⁻를 방출하여 물이 형성됩니다. 이때 남은 이온들이 결합하여 소금이 생성됩니다.
4. Oxidation-Reduction Reactions (산화 - 환원 반응)
[1] Oxidation-Reduction Reactions (산화-환원 반응)
: Redox Reaction라고도 한다.
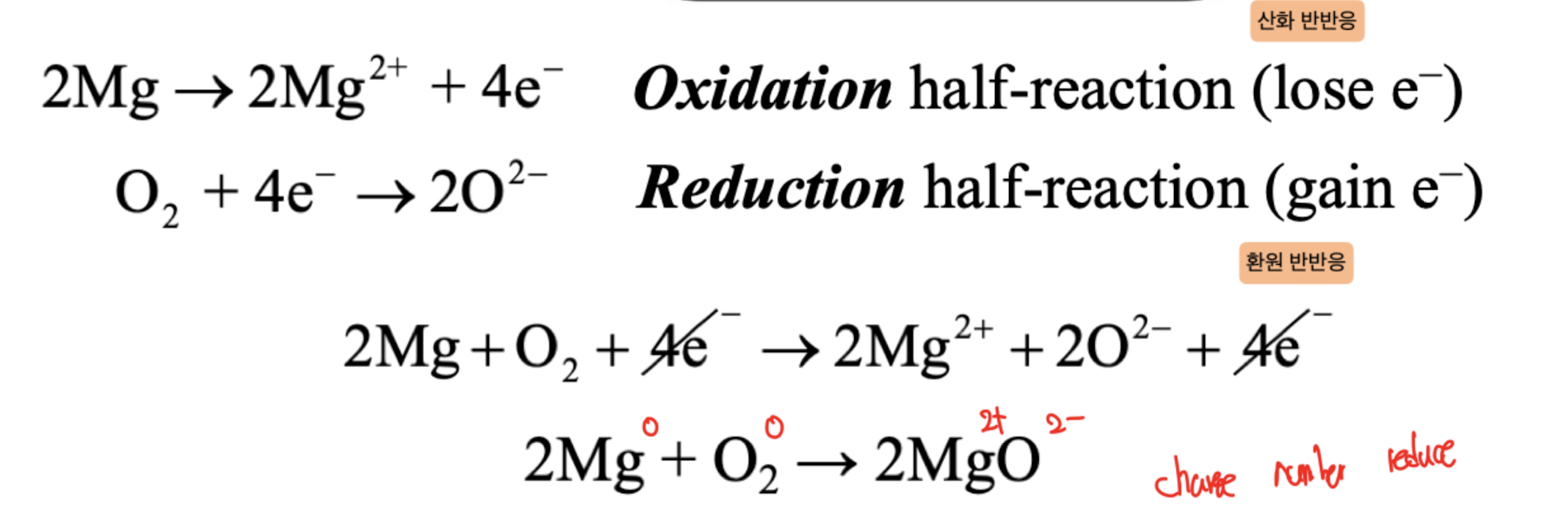
1) Oxidation half-reaction (lose e-)
: 산화 반응, 산화는 전자를 잃는 과정이다.
2) Reduction half-reaction (gain e-)
: 환원 반응, 환원은 전자를 얻는 과정이다.
[2] Oxidation-Reductio Reactions

1) 산화 (Oxidation)
: 전자를 잃는 과정
- 아연은 환원제(reducing agent) 역할을 하며, 전자를 잃어 산화된다.
2). 환원 (Reduction)
: 전자를 얻는 과정
- 구리 이온은 산화제(Oxidizing agent) 역할을 하며, 전자를 얻어 환원된다.

728x90