🏫 한동대학교/일반화학
[일반화학] Chapter7 - (2)
pangil_kim
2025. 3. 16. 21:43
728x90
일자 : 24-2 12주차 1차시
[4] 미스터리 #1, “가열된 고체 문제”가 플랑크에 의해 1900년에 해결됨
- 고체가 가열되면, 넓은 범위의 파장에서 전자기 복사(electromagnetic radiation)를 방출한다(emit)
- 특정 온도에서 물체가 방출하는 복사 에너지는 파장에 따라 달라진다.
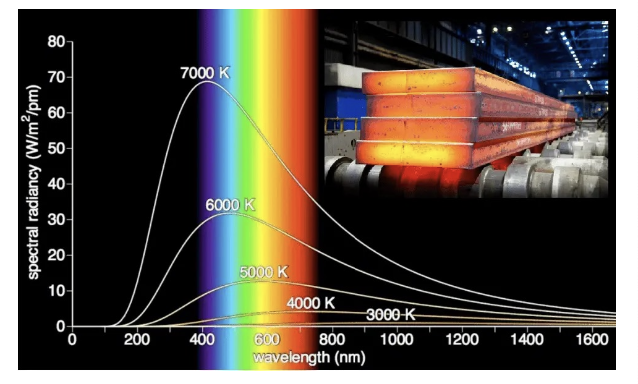
- 에너지(빛)는 이산적인 단위(양자)로 방출(emitted)되거나 흡수(absorbed)된다.
- E = h * v
- 플랑크 상수 (h)
- h = $6.63 \times 10^{-34}{J·s}$
- E = h * v
7.2 광전 효과
[1] 미스터리 #2, “광전 효과(Photoelectric Effect)”가 아인슈타인에 의해 1905년에 해결됨
- 빛은 다음 두 가지 성질을 가진다:
- 파동 성질 (wave nature)
- 입자 성질 (particle nature)
- 광자(Photon)는 빛의 "입자(particle)"이다.
- hv = KE + W
- KE = hv - W
- 여기서 W는 일함수로, 금속에서 전자가 얼마나 강하게 결합되어 있는지에 따라 결정된다..
7.3 Bohr’s Theory of the Hydrogen Atom
[1] 수소 원자의 선 방출 스펙트럼(Line Emission Spectrum of Hydrogen Atoms)
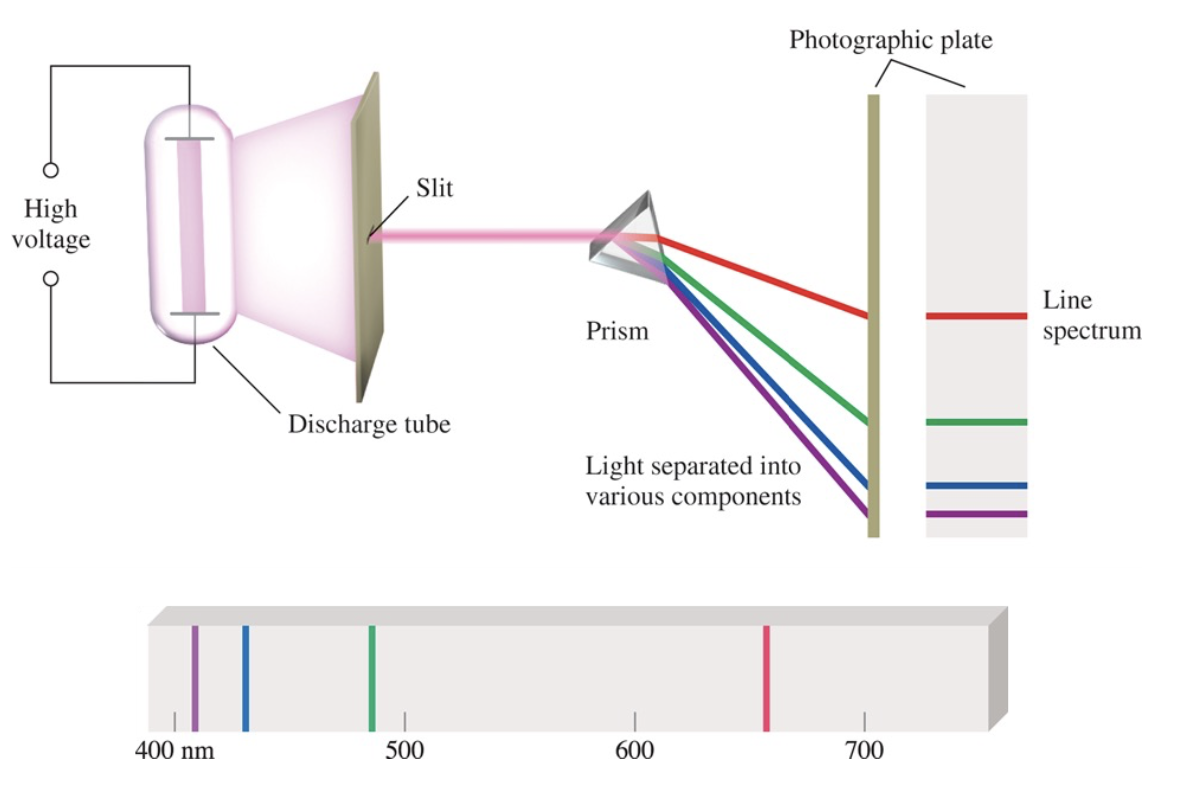
1) 실험 장치 구성:
- 고전압(High voltage) 전원
- 방전관(Discharge tube): 수소 기체가 들어있는 관
- 슬릿(Slit): 빛을 한 방향으로 모아주는 틈
- 프리즘(Prism): 빛을 파장별로 분리
- 사진 건판(Photographic plate): 분리된 빛을 기록
2) 작동 과정:
- 방전관에 고전압을 가하면 수소 원자가 빛을 방출
- 방출된 빛이 슬릿을 통과
- 프리즘에서 각각의 파장으로 분리
- 분리된 빛이 사진 건판에 기록됨
3) 스펙트럼 결과:
- 400nm에서 700nm 사이의 파장 영역에서 특정한 색의 선들이 나타남
- 보라색(~400nm)
- 파란색(434nm)
- 녹색(486nm)
- 빨간색(656nm)
4) 결론
: 이것은 수소 원자가 특정한 파장의 빛만을 방출한다는 것을 보여주는 중요한 실험으로, 원자의 에너지 준위가 불연속적이라는 것을 증명하는 증거가 된다.
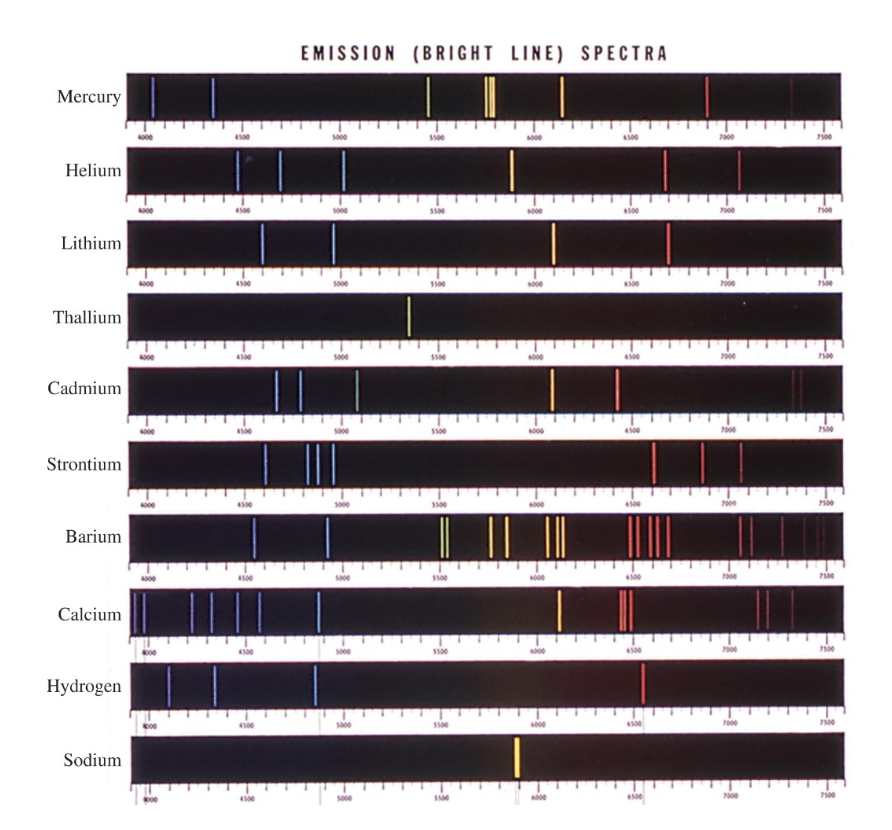
[2] Emission Spectra of Some Elements
: 일부 원소의 방출 스펙트럼
[3] 보어의 원자 모형 (1913)
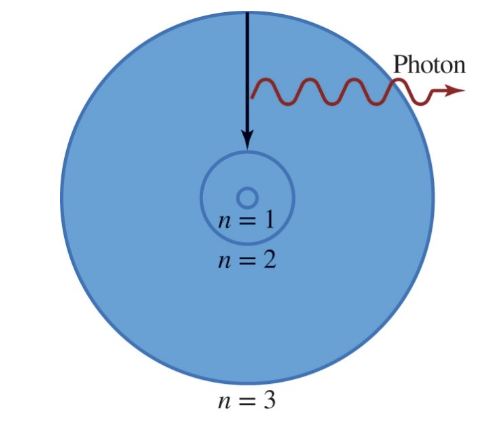
전자($e^-$)는 특정한 (양자화된) 에너지만 가질 수 있었다.
전자($e^-$)가 높은 에너지 준위에서 낮은 에너지 준위로 이동할 때 빛이 방출되었다.
- 에너지 준위 $E_n = -R_H \times \frac1 {n^2}$로 계산된다.
- 여기서 n(주양자수)은 1, 2, 3, ... 과 같은 자연수이다.
- $R_H$(라이덴베르크 상수)는 $2.18 \times 10^{-18} J$였다.
[4] Quantized Energy (정량화된 에너지)
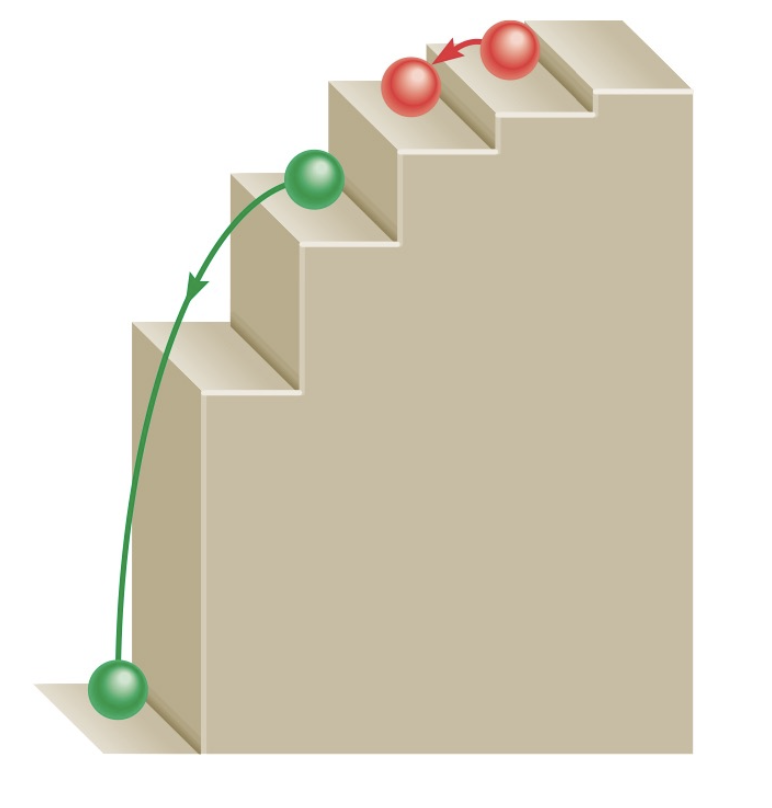
1) 계단식 구조:
- 각 계단은 서로 다른 에너지 준위를 나타냄
- 에너지 준위가 불연속적(discrete)으로 존재함을 보여줌
- 중간 단계는 존재하지 않음을 의미
2) 입자의 움직임:
- 초록색 구는 낮은 에너지 준위에서 높은 에너지 준위로 도약하는 것을 보여줌 (에너지 흡수)
- 빨간색 구들은 높은 에너지 준위에서 낮은 에너지 준위로 단계적으로 이동하는 것을 보여줌 (에너지 방출)
3) 핵심 개념:
- 에너지는 연속적이지 않고 특정한 값만을 가질 수 있음
- 입자는 한 에너지 준위에서 다른 준위로 '도약'함
- 중간 상태는 존재할 수 없음
4) 결론
이는 고전 물리학의 연속적인 에너지 개념과 다른, 양자역학의 기본 원리를 보여주는 중요한 개념이다. 보어의 원자 모형에서 전자의 에너지 준위가 양자화되어 있다는 것을 시각적으로 잘 설명해주고 있다.
[5] 수소 원자의 에너지 전이(Energy Transitions of the Hydrogen Atom)를 보여주는 도표
: 이 도표는 수소 원자에서 관찰되는 선 스펙트럼의 원리를 설명하고, 보어의 원자 모형과 양자화된 에너지 준위의 개념을 잘 보여준다.
1) 주요 구성
- 세로축: 에너지 준위 (n=1부터 ∞까지)
- 화살표: 전자의 에너지 준위 전이
- 수식: 광자 에너지와 에너지 준위 계산식
2) 스펙트럼 계열
- 라이먼 계열(Lyman series): n=1로 전이
- 발머 계열(Balmer series): n=2로 전이
- 파셴 계열(Paschen series): n=3으로 전이
- 브래킷 계열(Brackett series): n=4로 전이
3) 에너지 계산식
- Ephoton = ΔE = $E_f$ - $E_i$ (방출되는 광자의 에너지)
- $E_f$ = -RH(1/nf²) (최종 에너지 준위)
- $E_i$ = -RH(1/ni²) (초기 에너지 준위)
- ΔE = RH(1/ni² - 1/nf²) (에너지 차이)
여기서 RH는 리드베리 상수
4) 특징
- 높은 에너지 준위에서 낮은 준위로 전이할 때 빛(광자)이 방출됨
- 각 계열은 특정 파장의 스펙트럼선을 만듦
- 전이할 수 있는 에너지 준위가 불연속적임
- 각 전이는 특정한 에너지(따라서 특정한 파장의 빛)를 가짐
[6] Hydrogen Atom Emission Series
1) The Various Series in Atomic Hydrogen Emission Spectrum
: 원자 수소 방출 스펙트럼의 다양한 시리즈
- 이 표는 수소 원자의 방출 스펙트럼에서 각 시리즈의 전이 준위와 스펙트럼 영역을 보여준다.
| 시리즈 | ( n_f ) | ( n_i ) | 스펙트럼 영역 |
|---|---|---|---|
| Lyman | 1 | 2, 3, 4, ... | 자외선 (Ultraviolet) |
| Balmer | 2 | 3, 4, 5, ... | 가시광선 및 자외선 (Visible and ultraviolet) |
| Paschen | 3 | 4, 5, 6, ... | 적외선 (Infrared) |
| Brackett | 4 | 5, 6, 7, ... | 적외선 (Infrared) |

728x90
