한동대학교/일반화학
[일반 화학] Chapter 8 - (1)
pangil_kim
2025. 3. 16. 21:44
728x90
일자 : 24-2 14주차 1차시
8. 원소들 간의 주기적 관계
8.1 주기율표의 발전
[1] 원소가 발견된 시기
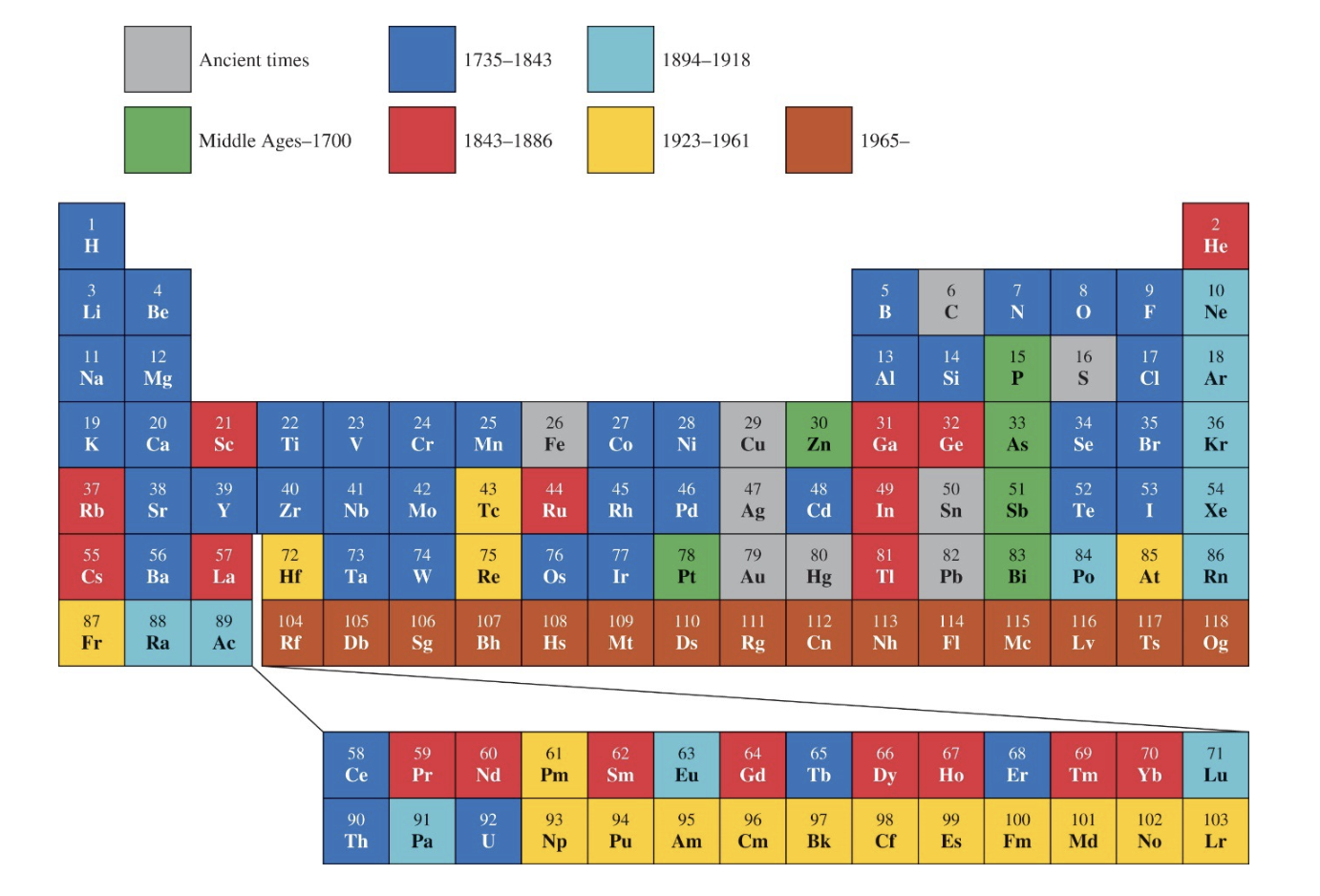
1) 색 의미
- 회색: 고대
- 초록색: 중세~1700
- 파란색: 1735~1843
- 빨간색: 1843~1886
- 하늘색: 1894~1918
- 노란색: 1923~1961
- 갈색: 1965~
2) 특징
- 발견 시기의 패턴:
- 고대부터 중세까지는 매우 제한된 수의 원소가 알려져 있었으며, 대부분 금속과 같은 자연에서 쉽게 발견되는 물질이었다.
- 18세기 이후, 화학 기술의 발전으로 많은 원소가 연속적으로 발견되었음을 알 수 있다.
- 산업혁명과 과학 혁신의 연관성:
- 특히 19세기(1843
1886)와 20세기 초반(18941918)에 원소 발견이 급격히 늘어났다. 이는 실험 기술의 발전과 산업 혁명으로 인한 과학적 관심 증가와 관련이 있다.
- 특히 19세기(1843
- 주기율표의 정교화:
- 각 시대에 새로 발견된 원소들은 주기율표의 틀을 더욱 정교하게 만들었고, 원소의 성질이 주기적으로 반복된다는 사실이 확인되었다.
- 현대 원소 발견:
- 20세기 중반부터 최근까지(노란색~갈색), 특히 인공적으로 합성된 원소들이 발견되면서 주기율표가 확장되었다.
8.2 원소의 주기적 분류
[1] 원소들의 바닥 상태 전자 배치
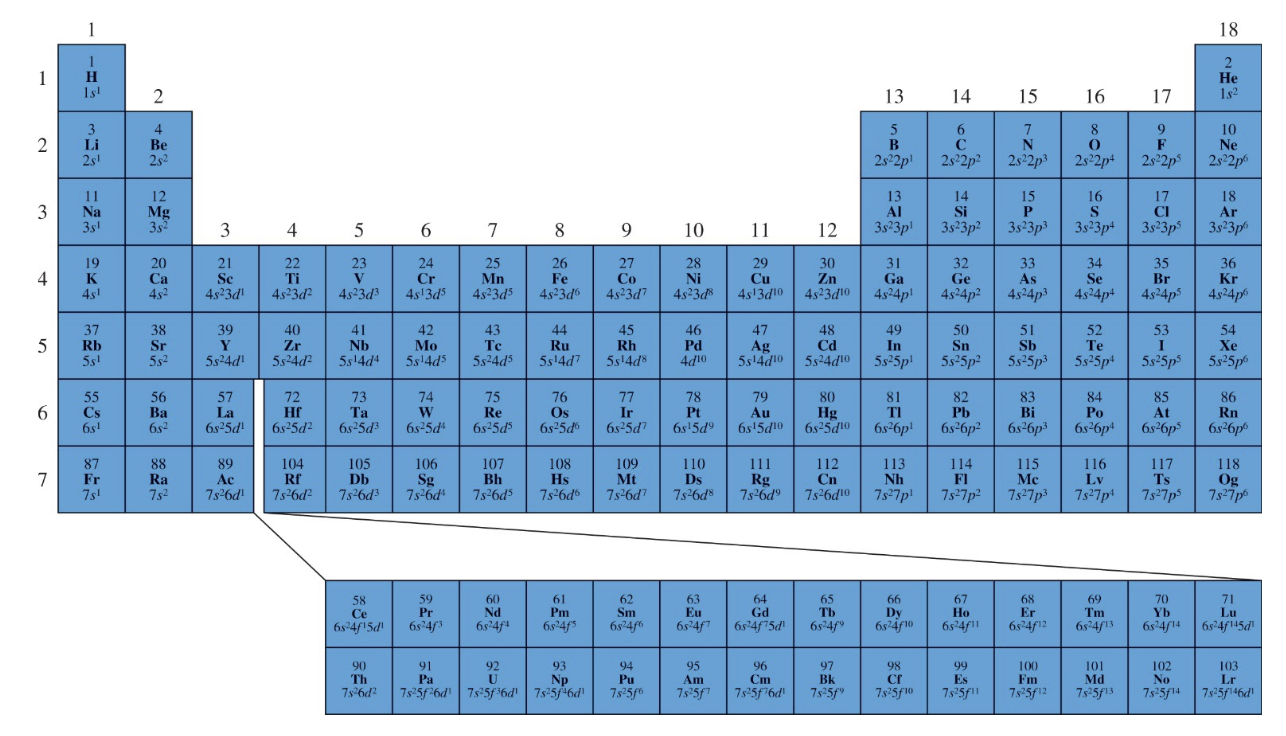
: 바닥 상태 전자 배치(Ground State Electron Configuration)는 원소가 가장 안정된 상태일 때 전자가 에너지 준위에 배치된 방식을 말한다.
1) 특징
- 주기와 전자 배치:
같은 주기(가로줄)에 있는 원소들은에너지 준위가 동일하지만, 전자가 채워지는 궤도함수의 수가 증가하면서 화학적 성질이 점진적으로 변화한다.
- 족과 화학적 성질:
같은 족(세로줄) 원소들은최외각 전자 수가 동일하여비슷한 화학적 성질을 가진다. 예를 들어, 알칼리 금속(1족)은 항상 하나의 최외각 전자를 가지며 반응성이 높다.
- 블록 구분:
- 주기율표는
전자 배치에 따라 **s-, p-, d-, f-블록**으로 나뉜다.이는 원소의 전자배치 특성과 주기적 성질을 쉽게 파악할 수 있도록 돕는다.
- 주기율표는
[2] 원소의 분류
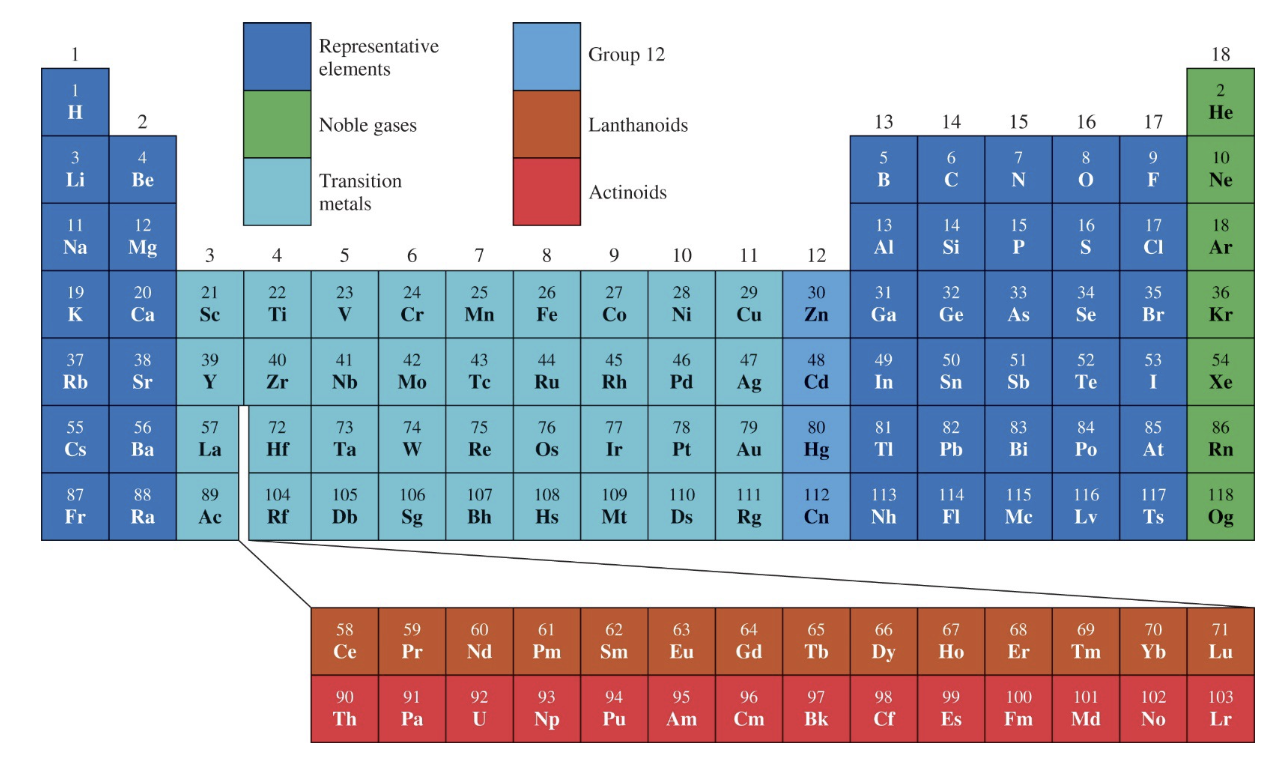
: 이 표는 주기율표에서 원소를 성질에 따라 주요 그룹으로 분류한 것이다.
1) 종류
- 파란색: 대표 원소(Representative elements):
s-와 p-블록 원소로 구성되며, 화학적 성질이 다양하다. 예를 들어, 1족의 알칼리 금속부터 17족의 할로젠까지 포함한다.
- 초록색: 비활성 기체(Noble gases):
18족 원소로, 완전한 전자껍질을 가져화학적으로 매우 안정하다.
- 파다색: 전이 금속(Transition metals):
d-블록 원소로, 다양한 산화 상태를 가지며 촉매로 자주 사용된다.
- 하늘색: 12족 원소(Group 12):
전이 금속으로 분류되지만, 화학적 성질은 전이 금속보다 대표 원소에 더 가깝다.아연(Zn), 카드뮴(Cd), 수은(Hg) 등이 포함된다.
- 갈색: 란타노이드(Lanthanoids):
f-블록의 첫 번째 계열로,희토류 원소에 속하며 주로 합금이나 촉매에 사용된다.
- 빨간색: 악티노이드(Actinoids):
f-블록의 두 번째 계열로, 대부분방사능을 가지며 우라늄(U)과 같은 핵연료에 사용된다.
2) Inner Shell / Outer Shell
- Inner Shell (내각 전자껍질):
원자핵에 가까운 낮은 에너지 준위의 전자껍질로, 화학 반응에 직접 관여하지 않으며 원자 구조의 안정성을 유지한다.
예: 1s², 2s², 2p⁶ (내각 전자) - Outer Shell (외각 전자껍질):
원자핵에서 가장 멀리 떨어진 높은 에너지 준위의 전자껍질로, 화학 반응과 결합에 직접적으로 참여한다.
예: 3s², 3p³ (외각 전자)
3) 반자성 (Diamagnetic) / 상자성 (Paramagnetic)
핵심 차이: 홀전자의 존재 여부로 구분된다.
- 반자성(Diamagnetic):
모든 전자가 짝을 이루고 있어 자석에 약하게 밀려나는 성질을 가진다.
예: Be (전자배치: 1s² 2s²) - 상자성(Paramagnetic):
짝지어지지 않은 홀전자를 가지고 있어 자석에 약하게 끌리는 성질을 가진다.
예: P (전자배치: 1s² 2s² 2p⁶ 3s² 3p³, 3개의 홀전자 있음)
[3] 양이온과 음이온의 전형적인 전자 배치
1) 양이온(Cations): 전자를 잃어 비활성 기체와 같은 전자 배치를 형성
- 원자가 양이온이 될 때, 외각 전자를 잃어 비활성 기체의 전자 배치와 동일한 상태가 된다.
- ( Na ): ( [Ne]3s^1 \rightarrow Na^+ : [Ne] ) (1개의 전자 손실)
- ( Ca ): ( [Ar]4s^2 \rightarrow Ca^{2+} : [Ar] ) (2개의 전자 손실)
- ( Al ): ( [Ne]3s^2 3p^1 \rightarrow Al^{3+} : [Ne] ) (3개의 전자 손실)
- 특징:
양이온은 양전하를 가지며, 외각 전자껍질이 비어 있는 상태로 안정화된다.
2) 음이온(Anions): 전자를 얻어 비활성 기체와 같은 전자 배치를 형성
- 원자가 음이온이 될 때, 전자를 추가하여 비활성 기체의 전자 배치와 동일한 상태가 된다.
- ( F ): ( 1s^2 2s^2 2p^5 \rightarrow F^- : 1s^2 2s^2 2p^6 ) (1개의 전자 추가)
- ( O ): ( 1s^2 2s^2 2p^4 \rightarrow O^{2-} : 1s^2 2s^2 2p^6 ) (2개의 전자 추가)
- ( N ): ( 1s^2 2s^2 2p^3 \rightarrow N^{3-} : 1s^2 2s^2 2p^6 ) (3개의 전자 추가)
- 특징:
음이온은 음전하를 가지며, 외각 전자껍질이 완전히 채워져 안정화된다.
핵심 요약
- 양이온(Cations): 전자를 잃어 비활성 기체의 외각 전자 배치를 형성.
- 음이온(Anions): 전자를 얻어 비활성 기체의 외각 전자 배치를 형성.
이를 통해 원소들은 안정적인 전자 배치를 달성하고, 화학적 반응에서의 성질을 결정한다.
[4] 동일 전자 수를 가진 이온들 (Isoelectronic Species)
- 동일 전자 수를 가진 이온들: 같은 수의 전자를 가지고 있으며, 따라서 동일한 기저 상태 전자 배치를 가진다.
1) 예시
- ( Na^+ )
- ( Al^{3+} : [Ne] )
- ( O^{2-} : 1s^2 2s^2 2p^6 ) 또는 ( [Ne] )
- ( F^- : 1s^2 2s^2 2p^6 ) 또는 ( [Ne] )
- ( N^{3-} : 1s^2 2s^2 2p^6 ) 또는 ( [Ne] )
2) 특징
- ( Na^+ ), ( Al^{3+} ), ( F^- ), ( O^{2-} ), 그리고 ( N^{3-} )은 모두 Ne와 동일한 전자 배치를 가지며, 따라서 이들은 동일 전자 수를 가진 이온들이다.
[5] 전이 금속 이온의 전자 배치
- 전이 금속에서 이온이 형성될 때, 전자는 항상 ns 궤도에서 먼저 제거되고, 그다음에 (n − 1)d 궤도에서 제거된다.
1) 예시
- Fe: ( [Ar] 4s^2 3d^6 )
- ( Fe^{2+} ): ( [Ar] 4s^0 3d^6 ) 또는 ( [Ar] 3d^6 )
- ( Fe^{3+} ): ( [Ar] 4s^0 3d^5 ) 또는 ( [Ar] 3d^5 )
- Mn: ( [Ar] 4s^2 3d^5 )
- ( Mn^{2+} ): ( [Ar] 4s^0 3d^5 ) 또는 ( [Ar] 3d^5 )
8.3 물리적 성질의 주기적 변화
[1] 유효 핵전하 (Effective Nuclear Charge)
- 유효 핵전하 (( Z_{eff} ))는 전자가 느끼는 "양전하"를 의미한다.
- ( Z_{eff} = Z - \sigma )
- ( Z ): 원자 번호 (핵의 양전하)
- ( \sigma ): 차폐 상수 (Shielding constant), 0 < ( \sigma ) < ( Z )
- ( Z_{eff} \approx Z - \text{내각 전자 수} )
유효 핵전하의 개념은 원자 내에서 외각 전자가 핵의 양전하를 얼마나 효과적으로 느끼는지를 설명한다. 내각 전자들이 외각 전자들을 "차폐"하여 핵의 양전하 효과를 감소시키기 때문이다.
1) 예시
- Na (나트륨):
- 전자 배치: ( 1s^2 2s^2 2p^6 3s^1 )
- ( Z = 11 ), 내각 전자 수는 10개 (1s² 2s² 2p⁶)
- ( Z_{eff} = 11 - 10 = 1 )
- Cl (염소):
- 전자 배치: ( 1s^2 2s^2 2p^6 3s^2 3p^5 )
- ( Z = 17 ), 내각 전자 수는 10개 (1s² 2s² 2p⁶)
- ( Z_{eff} = 17 - 10 = 7 )
[2] 유효 핵전하 ($Z_{eff}$ )
유효 핵전하는 외각 전자가 핵과 상호작용하는 정도를 나타내며, 원자 반지름과 이온화 에너지 등 물리적 성질에 영향을 준다. ( Z_{eff} ) 값이 클수록 외각 전자는 더 강하게 핵에 끌리고, 원자의 크기는 작아지며, 이온화 에너지는 증가한다.
[3] 원자 반지름 (Atomic Radii)
1) 특징 1
- 금속 반지름 (Metallic Radius):
금속에서 원자들이 금속 결합을 형성할 때, 원자들 간의 거리를 나타낸다.
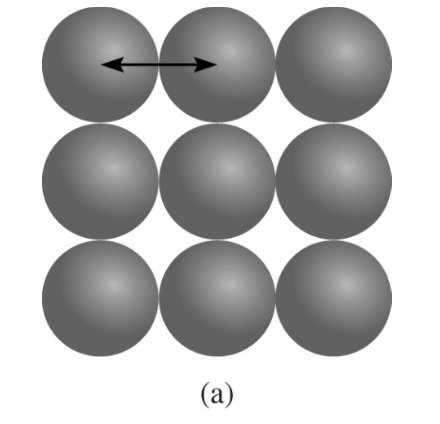
- 공유 결합 반지름 (Covalent Radius):
두 원자가 결합할 때, 공유 결합을 형성한 상태에서 원자들 간의 거리를 나타낸다.
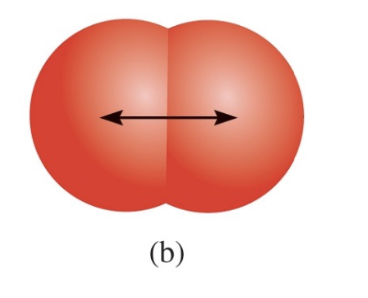
2) 특징 2
- 원자 반지름은 주기율표에서 같은 주기 내에서는 왼쪽에서 오른쪽으로 갈수록 작아지고, 같은 족에서는 위에서 아래로 갈수록 커진다.
- 왼쪽에서 오른쪽으로 갈수록 유효 핵전하가 증가하여 전자들이 더 강하게 핵에 끌리기 때문이다.
- 위에서 아래로 갈수록 새로운 전자 껍질이 추가되어 원자 반지름이 커진다.
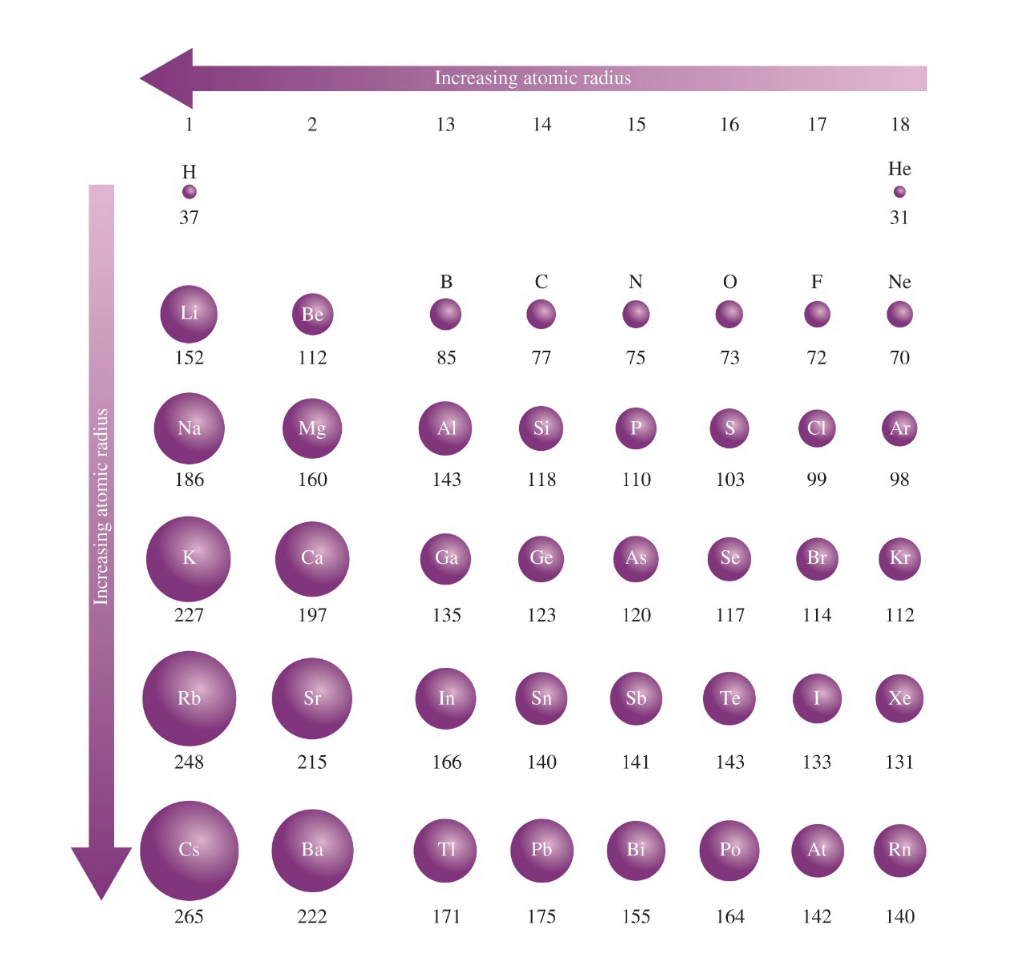
[4] 원자 반지름의 주기적 경향 (Trends in Atomic Radii)
원자 반지름은 주기율표에서 주기와 족에 따라 일정한 경향을 보인다:
- 주기: 원자 번호가 증가할수록 유효 핵전하가 증가하여 원자 반지름이 작아진다.
- 족: 원소가 아래로 내려갈수록 전자껍질이 추가되므로 원자 반지름이 커진다.
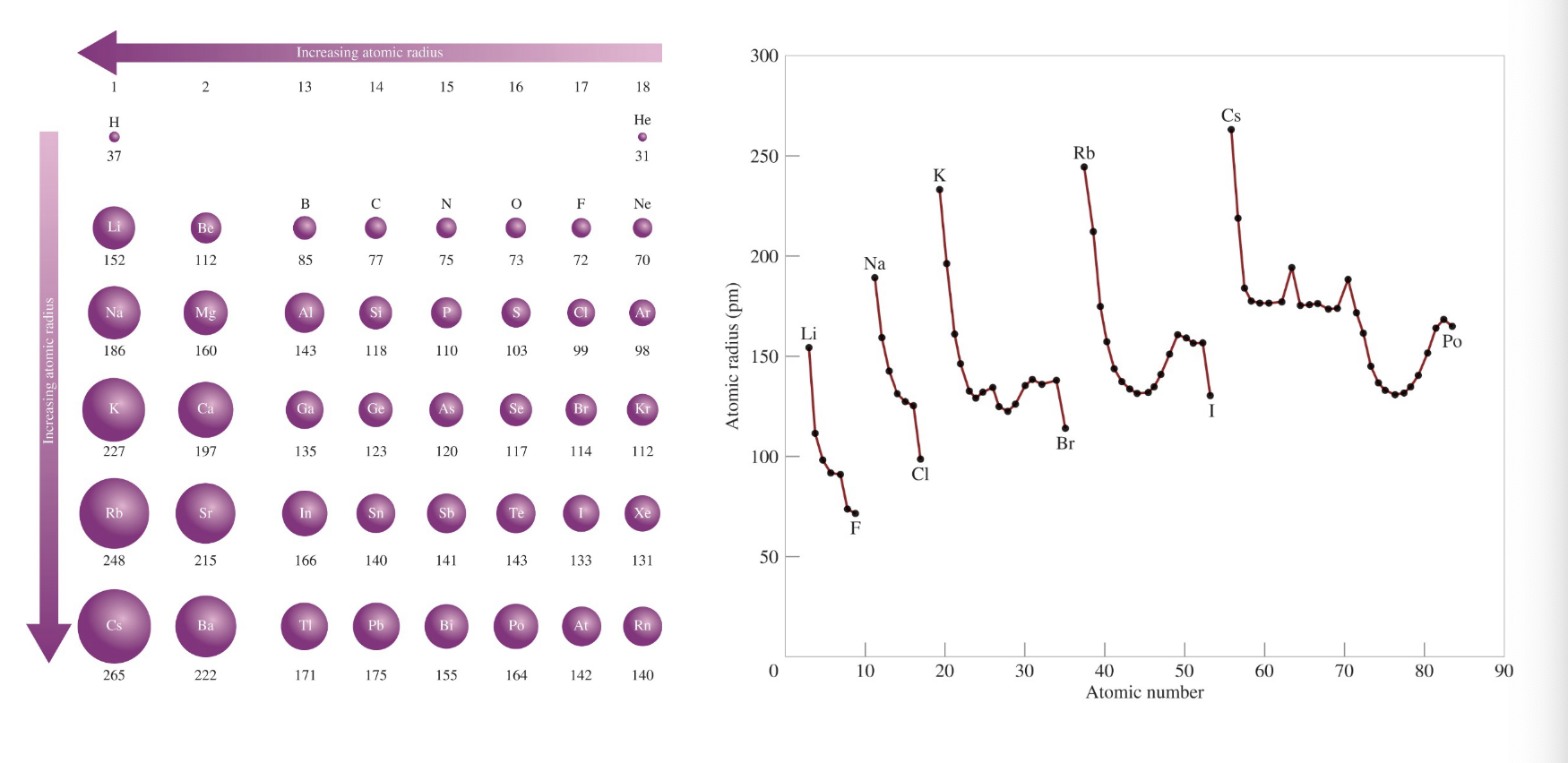
[5] 원자 반지름과 이온 반지름의 비교
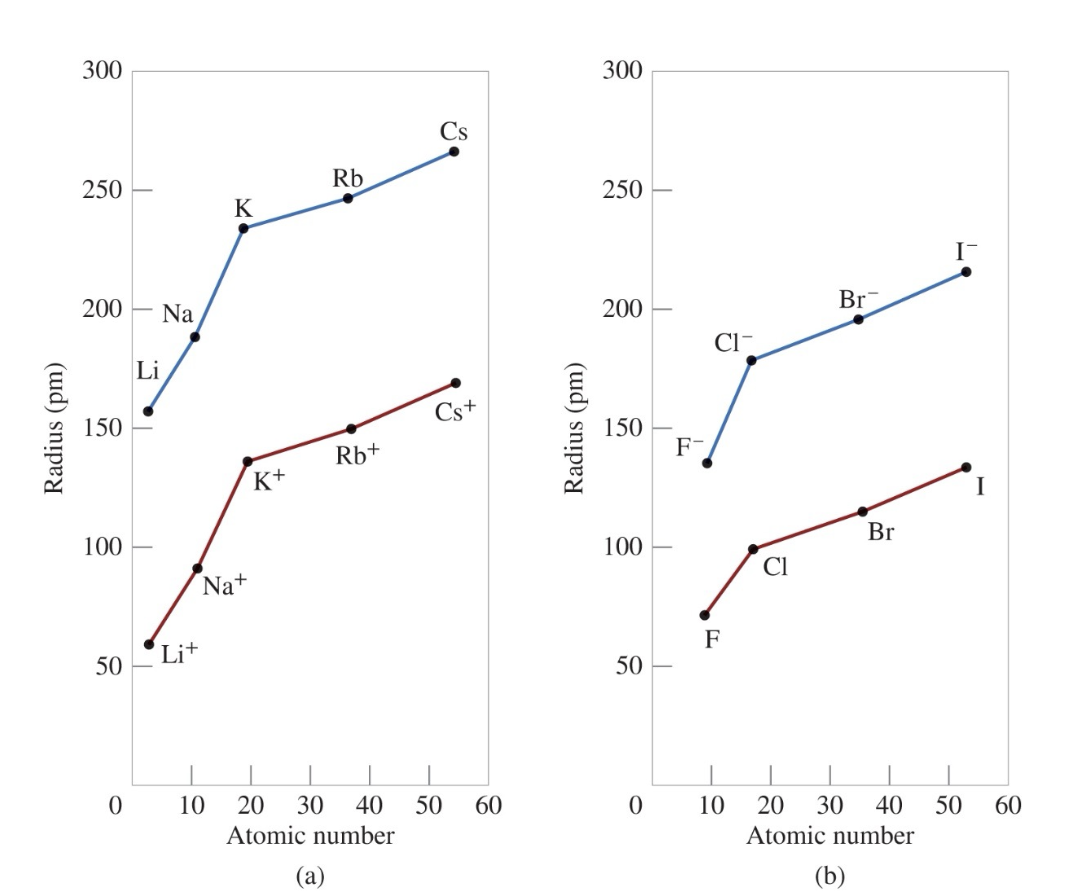
[6] 이온 크기
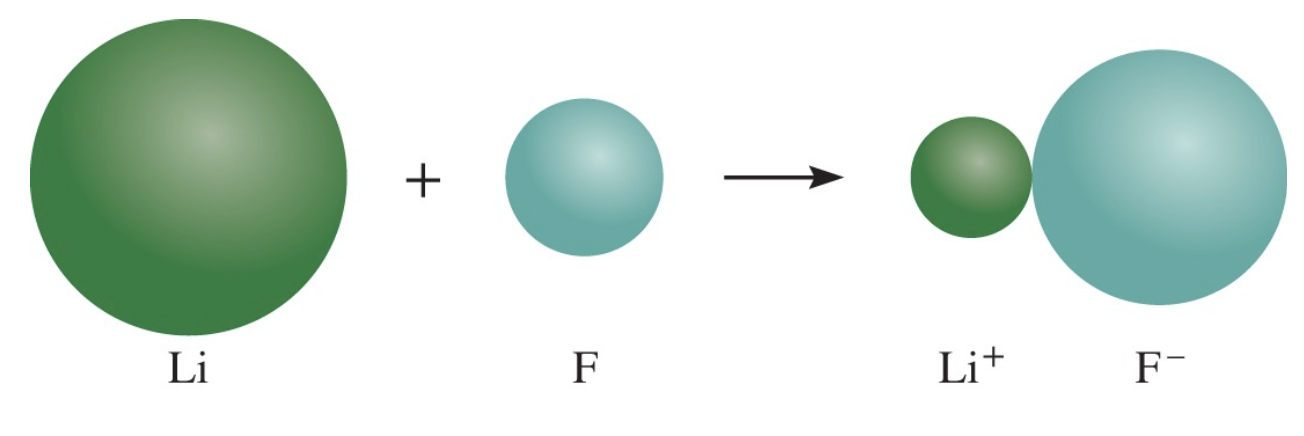
- 양이온 (Cation)은 그것이 형성된 원자보다 항상 크기가 작다.
- 음이온 (Anion)은 그것이 형성된 원자보다 항상 크기가 크다.
[7] 친숙한 원소들의 이온 반지름 (단위: pm)
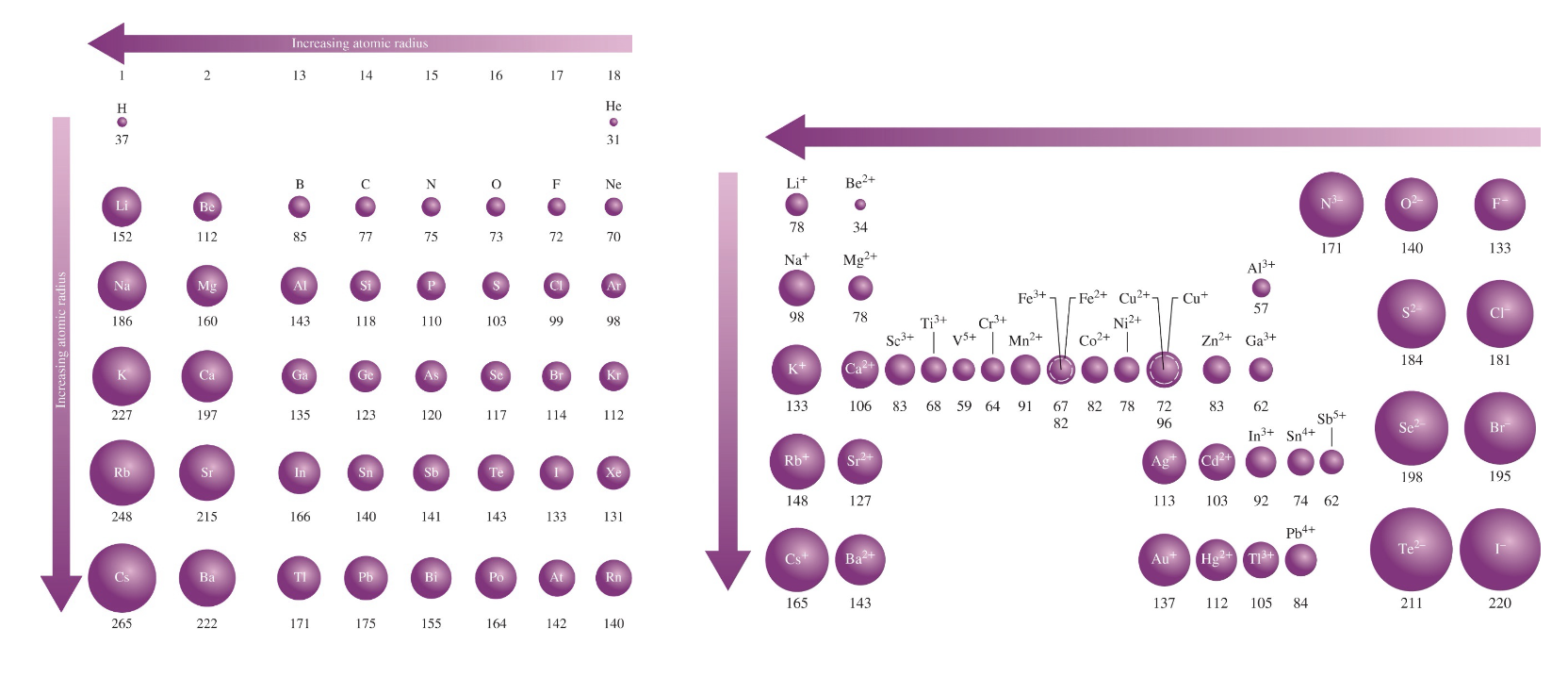
summary
8. 원소들 간의 주기적 관계
8.1 주기율표의 발전
[1] 원소가 발견된 시기
- 발견 시기의 패턴: 고대부터 현대까지의 원소 발견 시기와 연관된 과학 혁신 및 산업 혁명
- 산업혁명과 과학 혁신: 19세기와 20세기 초반의 원소 발견 급증
- 주기율표의 정교화: 새로 발견된 원소들로 인해 주기율표가 점차 완성됨
- 현대 원소 발견: 20세기 중반 이후 인공적으로 합성된 원소들
8.2 원소의 주기적 분류
[1] 원소들의 바닥 상태 전자 배치
- 주기와 전자 배치: 같은 주기의 원소들은 에너지 준위가 같지만 화학적 성질은 다름
- 족과 화학적 성질: 같은 족의 원소들은 비슷한 화학적 성질을 가짐
- 블록 구분: 주기율표는 전자 배치에 따라 s-, p-, d-, f-블록으로 구분됨
[2] 원소의 분류
- 대표 원소: s-와 p-블록 원소
- 비활성 기체: 18족 원소
- 전이 금속: d-블록 원소
- 12족 원소: 화학적 성질이 대표 원소에 가까운 전이 금속
- 란타노이드와 악티노이드: f-블록 원소, 희토류 및 방사능 원소들
- Inner/Outer Shell: 내각 전자와 외각 전자의 구분
- 반자성/상자성: 전자의 짝지음 여부에 따른 자성 구분
[3] 양이온과 음이온의 전형적인 전자 배치
- 양이온: 전자를 잃고 비활성 기체의 전자 배치를 형성
- 음이온: 전자를 얻어 비활성 기체의 전자 배치를 형성
- 동일 전자 수를 가진 이온들: 같은 전자 수를 가진 이온들의 전자 배치
- 전이 금속 이온의 전자 배치: 전이 금속에서 이온 형성 시 전자의 제거 순서
8.3 물리적 성질의 주기적 변화
[1] 유효 핵전하 (Effective Nuclear Charge)
- 정의: 외각 전자가 핵의 양전하를 얼마나 느끼는지
- 예시: Na와 Cl의 유효 핵전하 계산
[2] 유효 핵전하
- 영향: 원자 반지름, 이온화 에너지에 미치는 영향
[3] 원자 반지름 (Atomic Radii)
- 금속 반지름과 공유 결합 반지름: 원자들 간의 결합 거리
- 주기적 변화: 주기와 족에 따른 원자 반지름의 변화
- 이온 크기: 양이온은 원자보다 작고, 음이온은 원자보다 큼
[4] 원자 반지름과 이온 반지름 비교
- 비교: 원자 반지름과 이온 반지름의 차이점

728x90