🏫 한동대학교/일반화학
[일반 화학] Chapter 5 - (2)
pangil_kim
2025. 3. 14. 18:30
728x90
5.5. 기체 화학량론
[1] 기체 화학량론
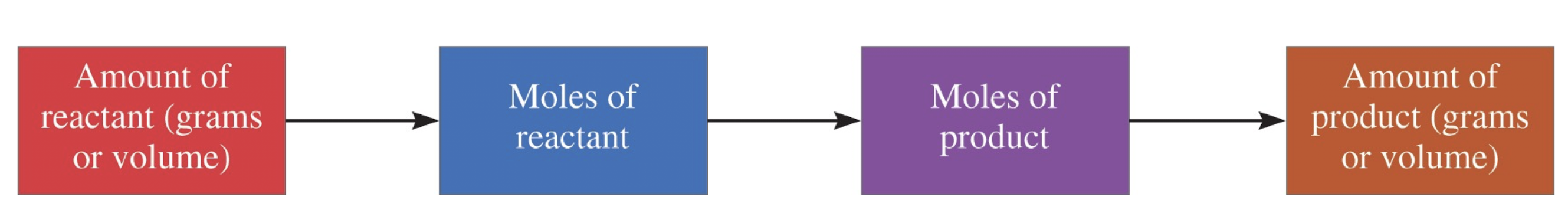
1) 기체 화학량론이란?
: 기체 화학량론은 기체 반응에서 물질의 양을 계산하는 방법이다.
- 총 4단계 : 반응물의 양 (그램 또는 부피) -> 반응물의 몰 -> 제품의 몰 -> 생성물의 양 (그램 또는 부피)
2) 단계 별 내용
- 반응물의 양 측정: 반응물의 질량(그램)이나 부피(리터)를 측정한다.
- 몰로 변환: 측정한 반응물의 양을 몰로 변환한다. (몰 수 = 질량(g) / 분자량(g/mol))
- 제품의 몰 계산: 반응식에 따라 반응물의 몰 수를 이용해 생성될 제품의 몰 수를 계산한다.
- 생성물의 양 계산: 마지막으로 계산한 제품의 몰 수를 질량(그램) 또는 부피(리터)로 변환하여 생성물의 양을 구한다.
5.6 달튼의 부분 압력의 법칙
[1] 달튼의 부분 압력 법칙
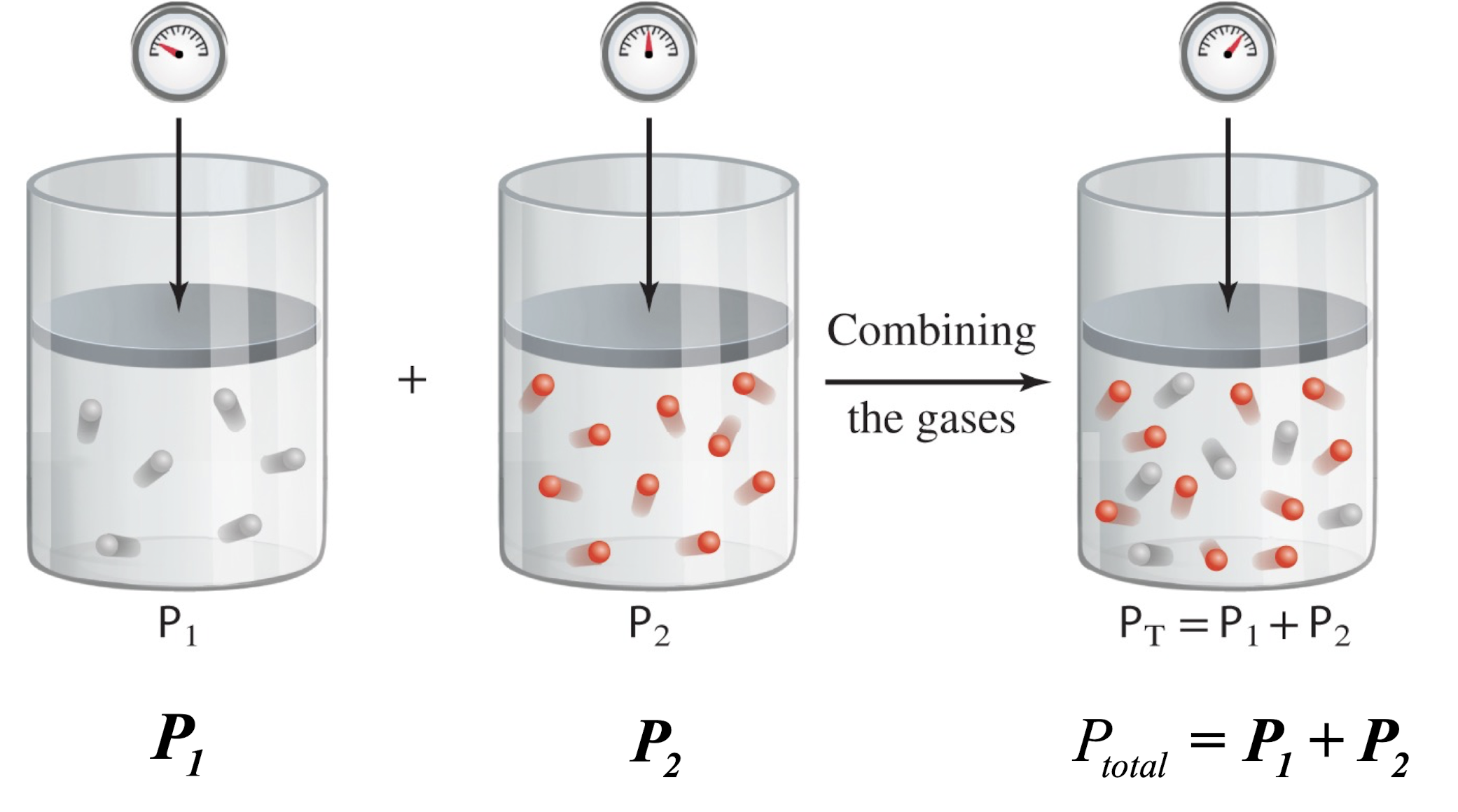
- Volumne과 Temperature가 상수이다. (변하지 않는 값)
- $$P_1 + P_2 = P_{\text{total}}$$
[2] 부분 압력 공식
1) 기본 설정
- 부피 V인 용기에 두 가지 기체 A와 B가 존재
- R: 기체상수
- T: 온도
2-1) 기체 A의 부분압력
$P_A = \frac{n_A RT}{V}$
- $n_A$: A의 몰수
2-2) 기체 B의 부분압력
$P_B = \frac{n_B RT}{V}$
- $n_B$: B의 몰수
2-3) 전체 압력 (달톤의 분압 법칙)
$P_T = P_A + P_B$
3-1) 몰분율 (Mole Fraction)
3-2) 기체 A의 몰분율
$X_A = \frac{n_A}{n_A + n_B}$
3-3) 기체 B의 몰분율
$X_B = \frac{n_B}{n_A + n_B}$
4. 부분압력과 몰분율의 관계
개별 기체
$P_A = X_A P_T$
$P_B = X_B P_T$일반화된 식
$P_i = X_i P_T$
- 여기서 i는 임의의 기체를 나타내며, $X_i$는 다음과 같이 정의 된다.
- $X_i = \frac{n_i}{n_T} = \frac{n_i}{\sum_{i=1}^n n_i}$
[3] 물로 기체 수집하기
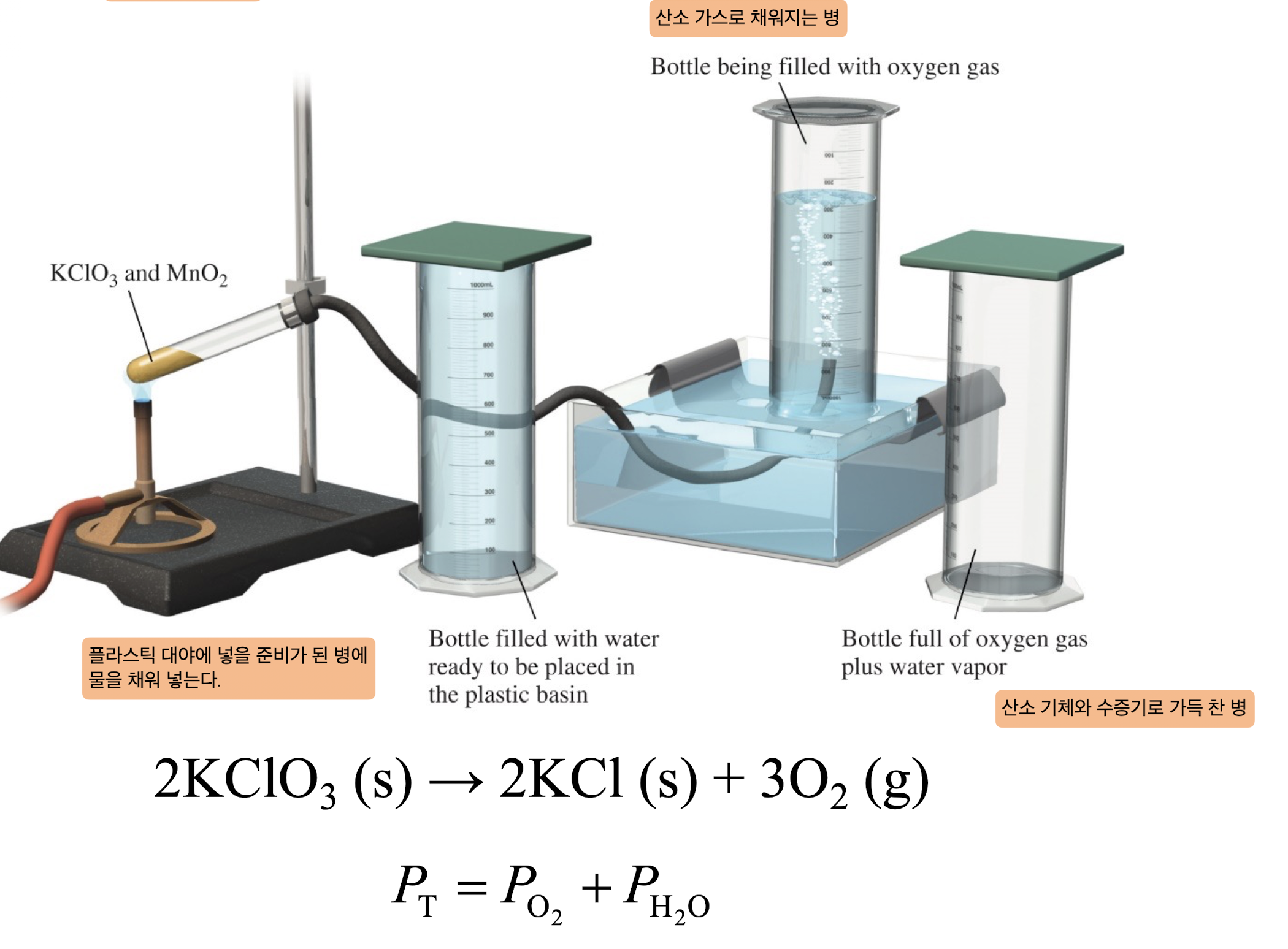
1) 과정
- 플라스틱 대야에 넣을 준비가 된 병에 물을 채워 넣는ㄴ다.
- 산소로 가득 채워지는 병
- 산소 기체와 수증기로 가득 찬 병
-> $P_T = P_{O_2} + P{H_2}O$
2) 기체 수집
: 물을 통해 기체를 수집하는 방법은 반응으로 발생하는 산소와 같은 기체를 쉽게 모을 수 있는 실험이다.
3) 증기압
: 물을 통해 수집할 때 기체에 포함되는 수증기의 압력 ($PH_2O$)을 고려해야 하며, 산소 기체의 실제 압력은 물의 증기압을 제외한 값으로 계산한다.
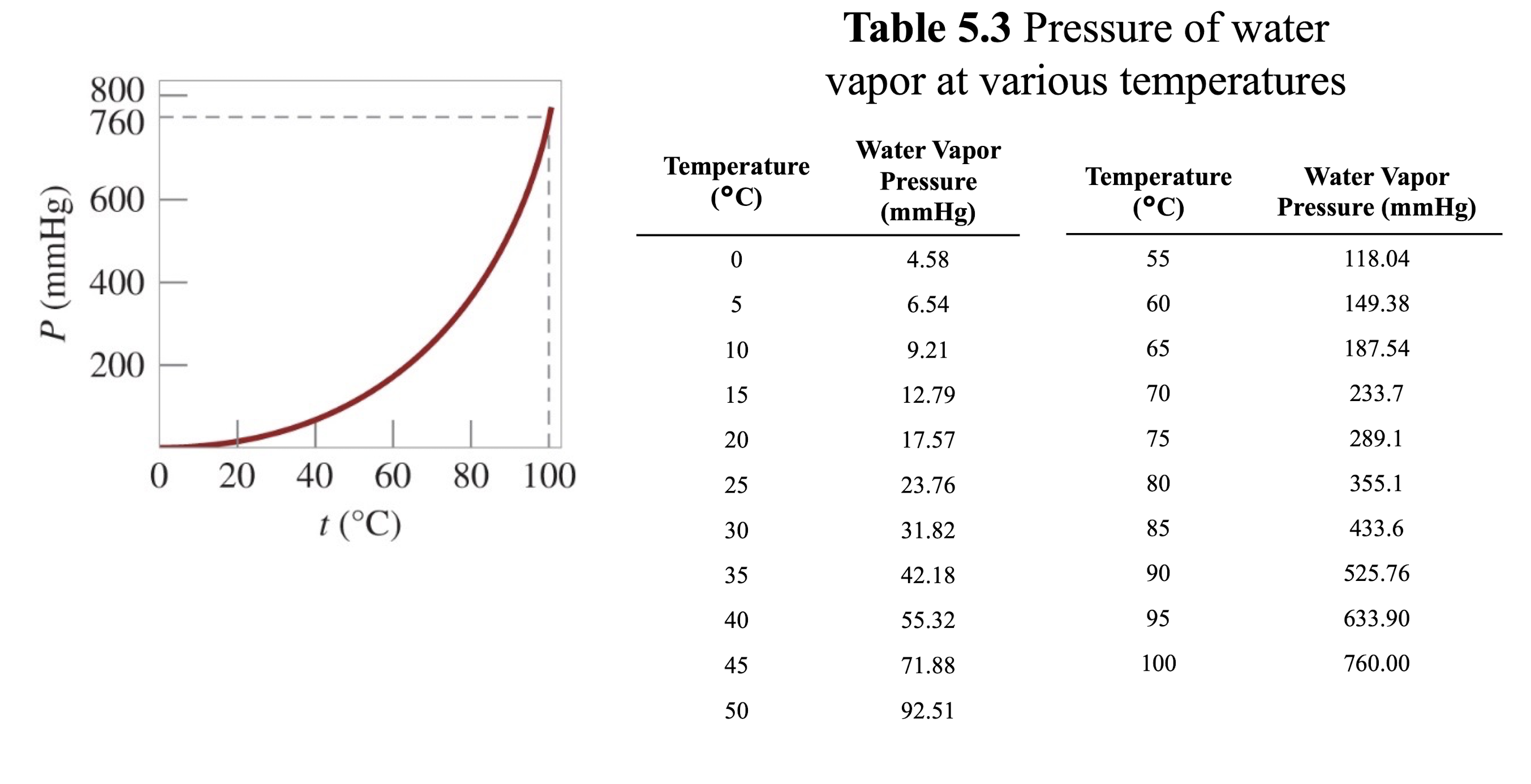
[4] 수증기의 온도
: 다양한 온도에서의 수증기의 압력은 상이하다. (온도가 높아질수록, 압력은 높아진다.)

728x90
