Notice
Recent Posts
Recent Comments
Link
250x250
| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | ||||
| 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| 25 | 26 | 27 | 28 | 29 | 30 | 31 |
Tags
- 데이터베이스
- 날솟샘
- 프론트엔드
- GLS
- typeScript
- SQL
- SQLD
- CCM
- 유태준교수님
- 남재창교수님
- 어노인팅
- FE
- 예배
- 날마다 솟는 샘물
- 전산전자공학부
- 설교
- 한동대학교
- 글로벌리더십학부
- QT
- csee
- dbms
- 묵상
- 혼자공부하는sql
- 화학
- 웹개발
- CHEMISTRY
- Database
- Software Engineering
- 일반화학
- 찬양
Archives
- Today
- Total
멈추지 않는 기록
[일반화학] Chapter 1 - (1) 본문
728x90
1.1 Chemistry : The Study of a Science for the Twenty-First Century (화학 : 21세기를 위한 과학의 학문)
[1] Chemistry : A Science for the 21st Century 화학 : 21세기를 위한 과학)
: 화학은 다양한 분야에서 발견할 수 있다.
- 건강과 의학
- 에너지와 환경
- 재료 및 기술
- 식량과 농업
[2] The Study of Chemistry
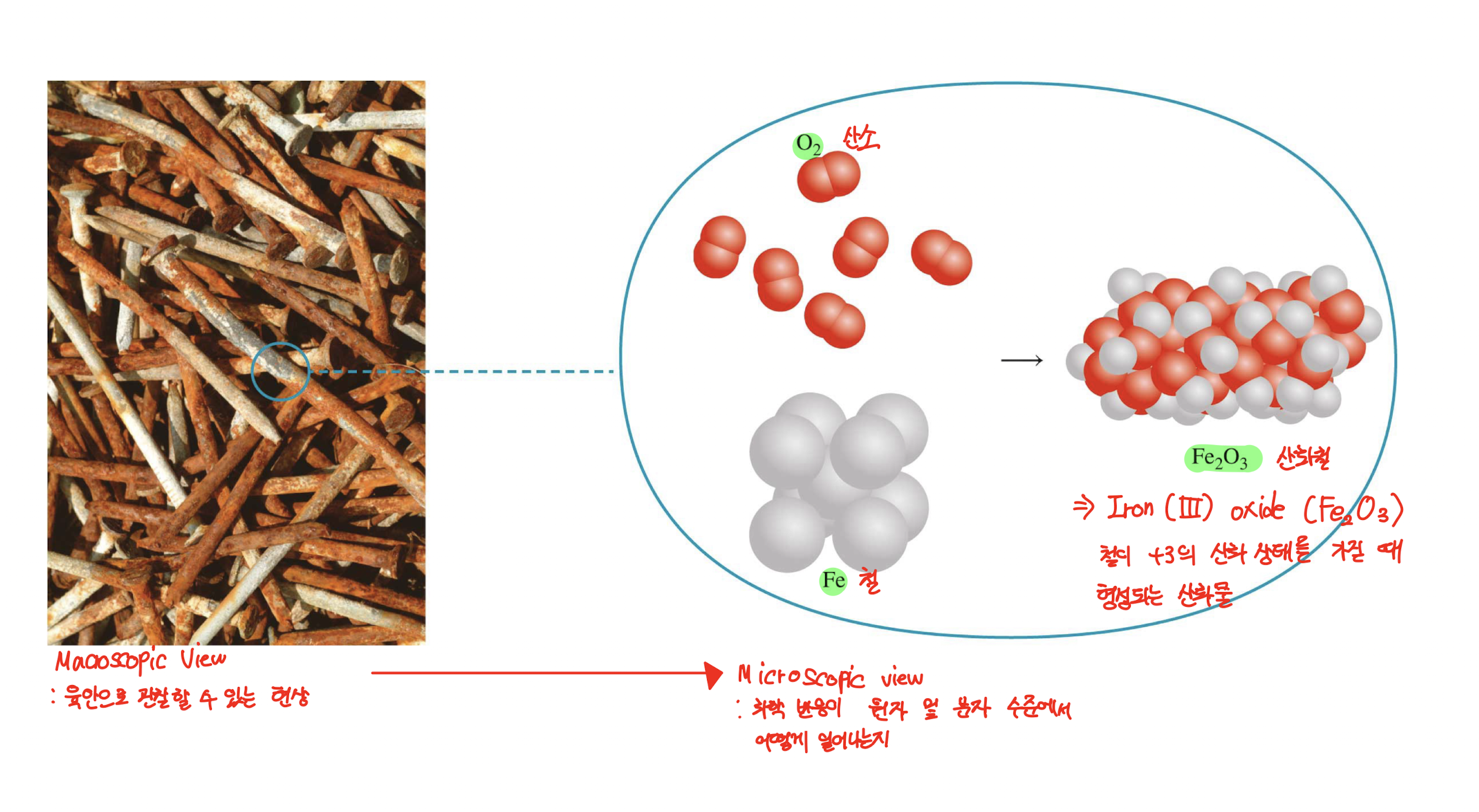
Macroscopic View
: 육안으로 관찰할 수 있는 현상에 대한 시점
- ex) 산화된 철의 모습을 우리의 육안에서 보는 것
2. Microscopic View
: 화학 반응이 원자 및 분자 수준에서 어떻게 일어나는지의 시점
- ex) 산화된 과정을 원자 및 분자 관점에서 보는 것
1.2 The Scientific Method (과학적 방법)
[1] The Scientific Method (과학적 방법)
: 과학적 방법은 체계적인 연구 접근법이다.
과학적 방법의 단계 (총 3단계)

- Observation 관찰
- Representation 표현
- Interpretation 해석
- 중요한 세 가지 개념 : logic, reason, principle
[2] Hypothesis (가설)
: 관찰된 현상에 대한 잠정적인 설명
- 이 실험을 통해 검증될 수 있는 예측을 포함한다.
- ex) 철이 산소와 반응하면 녹이 생길 것이라는 가설
[3] Law (법칙)
: 특정 조건 하에서 항상 동일하게 나타나는 현상 간의 관계를 간결하게 나타내는 진술
- ex) 뉴턴의 제 2법칙 ‘힙 = 질량 * 가속도’는 일정한 조건 하에서 항상 적용되는 물리 법칙이다.
[4] Theory (이론)
: 여러 관찰과 법칙을 통합하여 설명하는 원리
- 여러 가지 사실과 법칙을 설명하고 예측할 수 있는 포괄적인 틀을 제공한다.
1.3 Measurement 측정
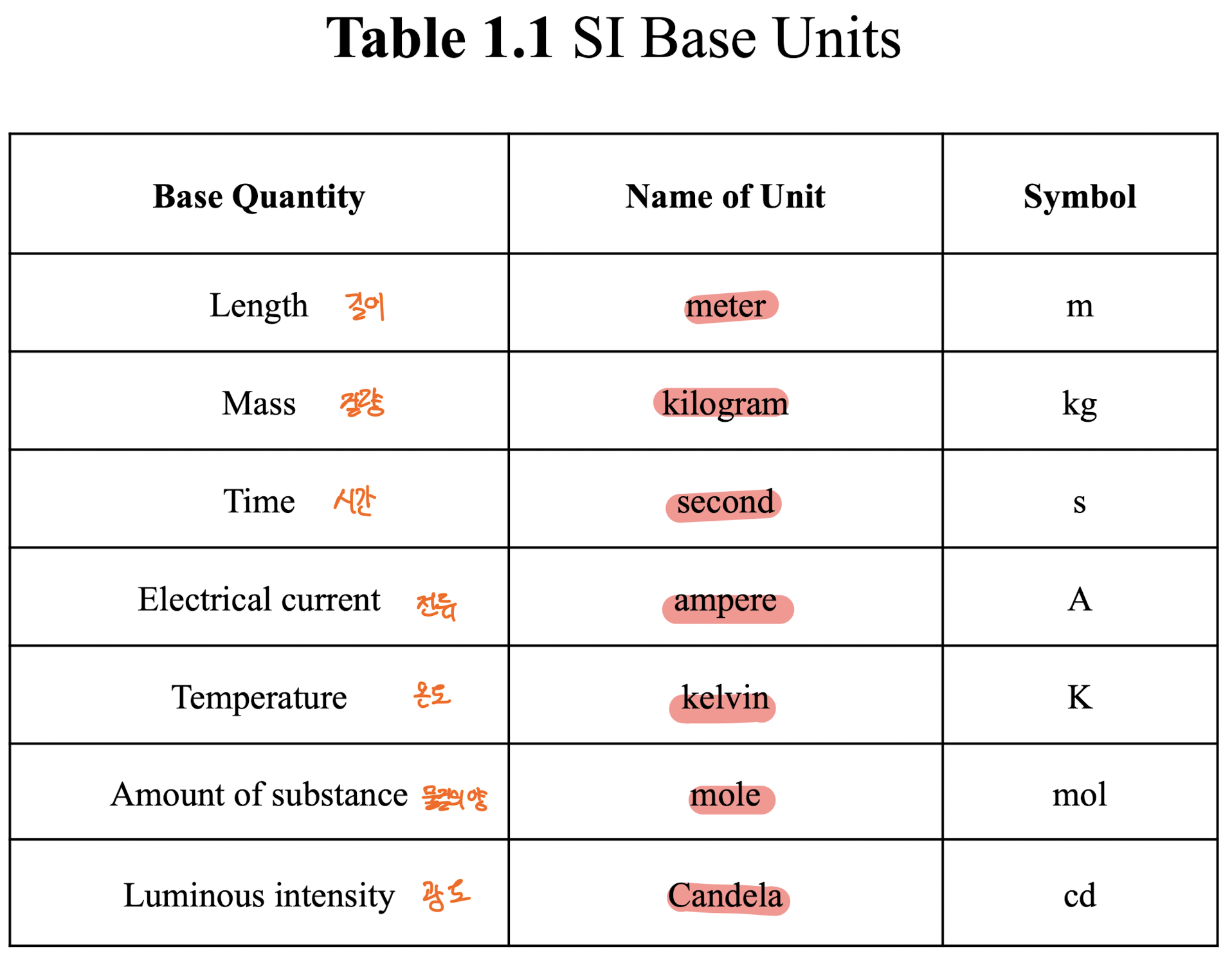
[1] International System of Units (SI) (국제 단위계)
: Scientific Method의 경우 logic, reason, principle과 관련이 있다.
→ 이를 측정할 단위가 필요하다.
SI Base Units
[2] Prefixes Used with SI Units
: : SI Units와 사용되는 접두사들이 존재한다.
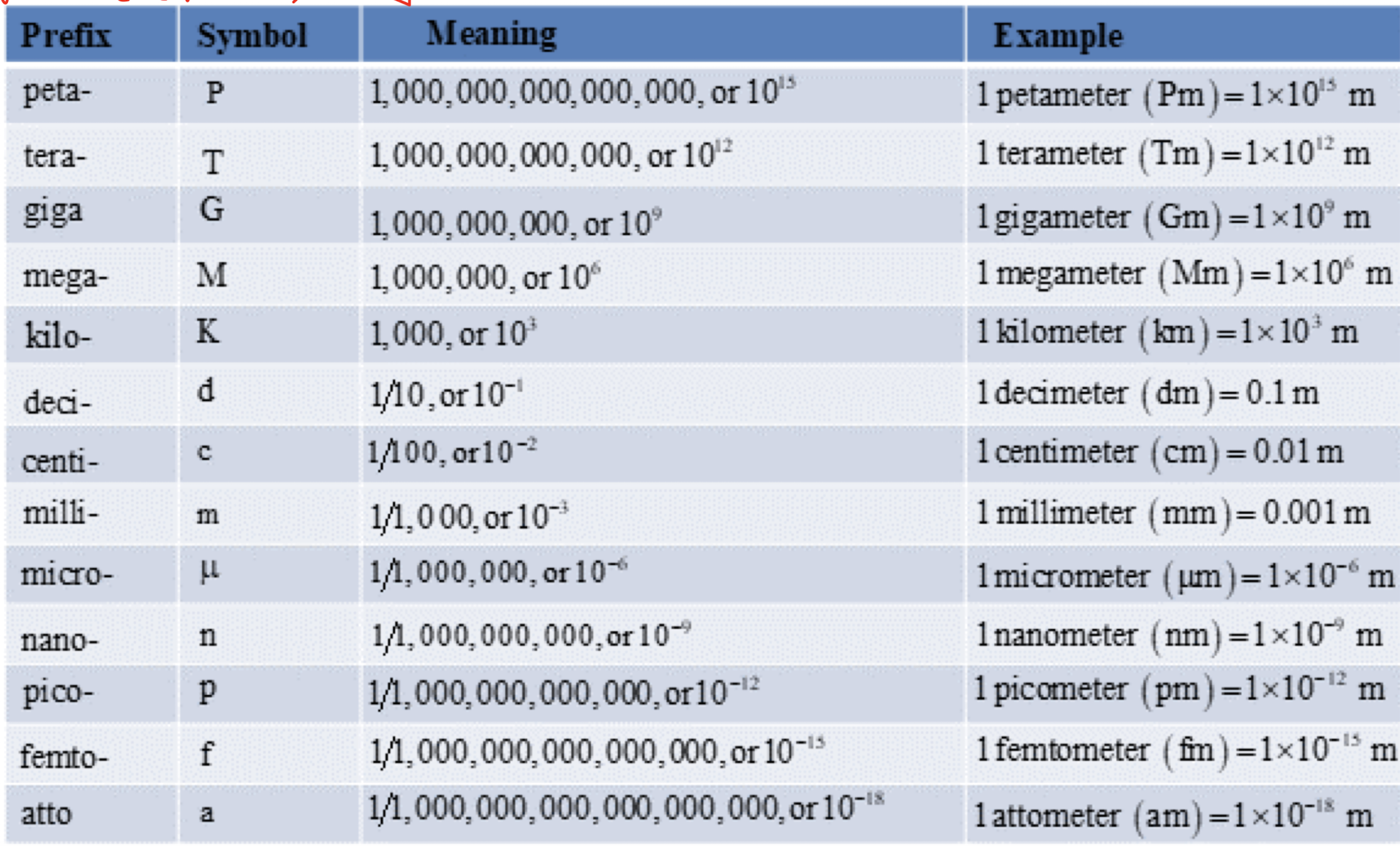
- ex) 1m의 경우 0.001m로 표현이 가능하다. → 0.001의 경우 10의 -3승이므로 ‘milli-’가 붙여져서 1mm가 된다.
- ex) 1s의 경우 0.001s로 표현이 가능하다. → 0.001의 경우 10의 -3승이므로 ‘milli’-가 붙여져서 1ms가 된다.
- ex) 1000kg에서 1000의 경우 10의 3승이므로 ‘mega-’가 붙여서 1Mg가 된다.
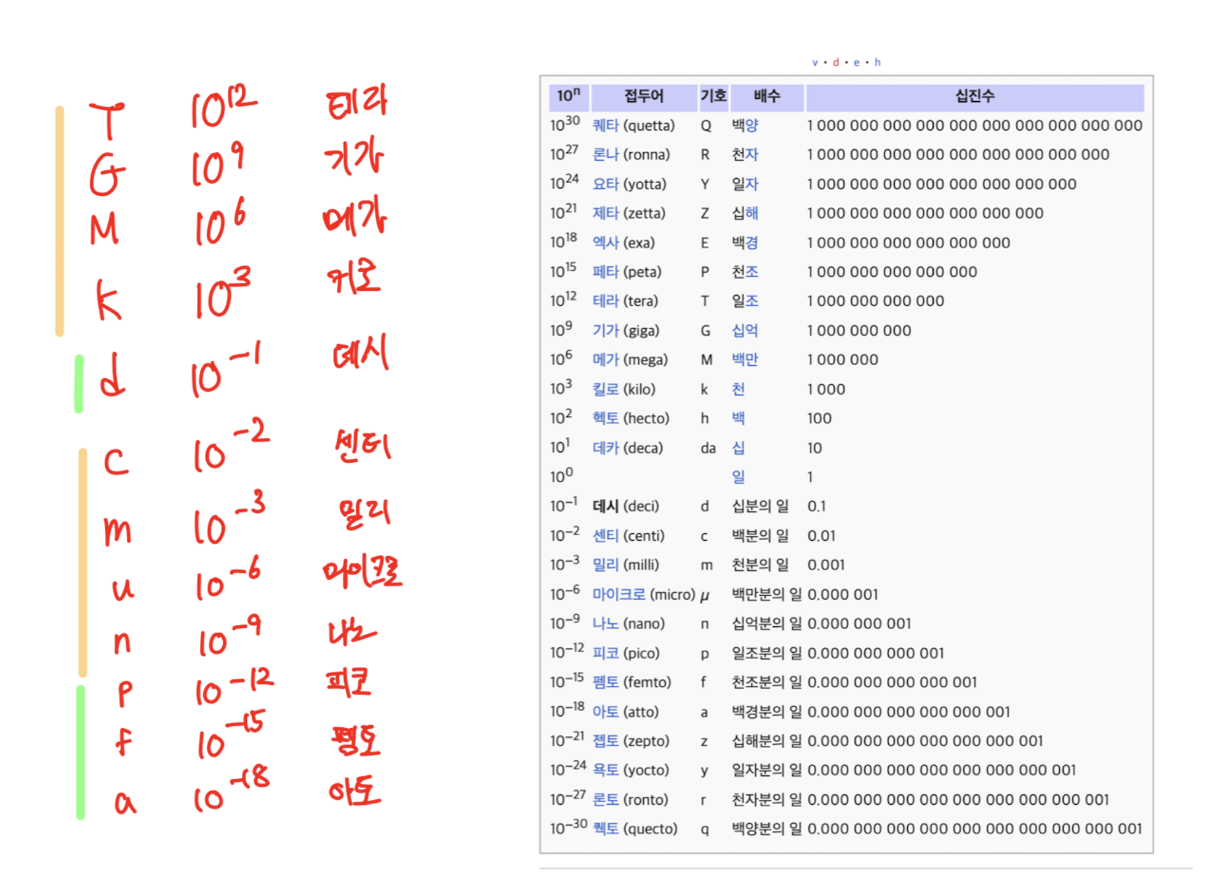
나무위키에서 제공하고 있는 보다 자세한 Prefixes 모음
[3] Volume (용량)
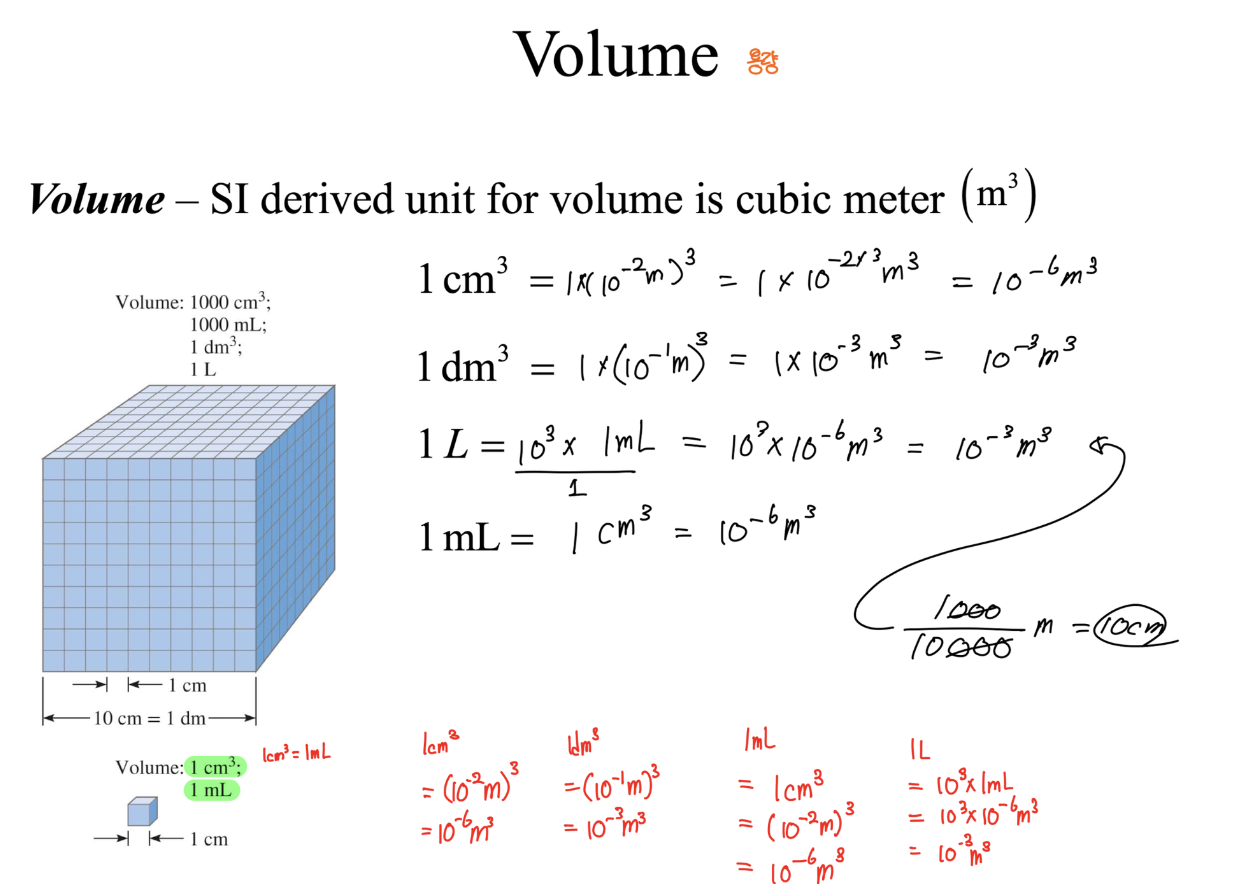
- 단위 : m^3
- 1cm^3 = 1mL
[4] Density (밀도)
- 단위 : kg/m^3
- 밀도 (P) = 질량(M) / 부피 (V)
- 1g/cm^3 = 10^3kg / m^3
과정 / 요약 / 꿀팁
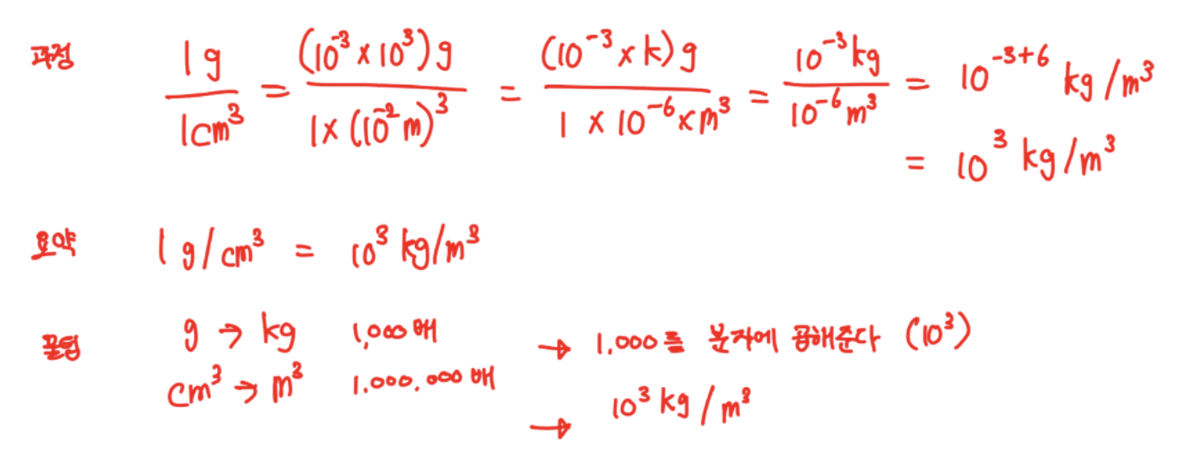
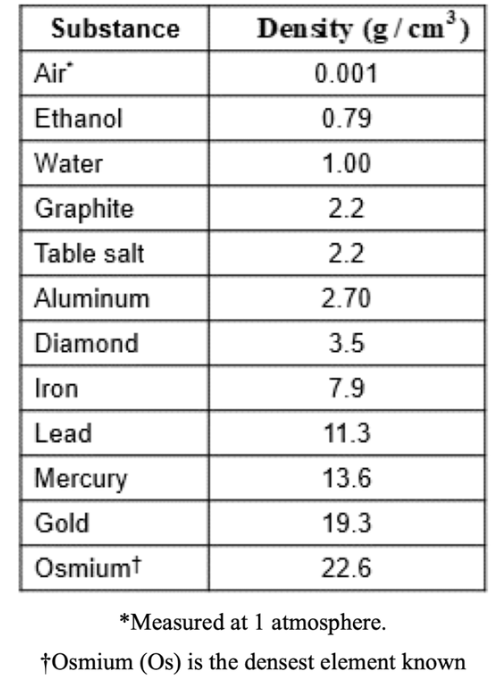
### Densities of Some Substances 일부 물질에서의 밀도
- ex) 25℃에서 일부 물질의 밀도
A Comparison of Temperature Scales 온도 눈금 비교 (Kelvin, Celsius, Fahrenheit)
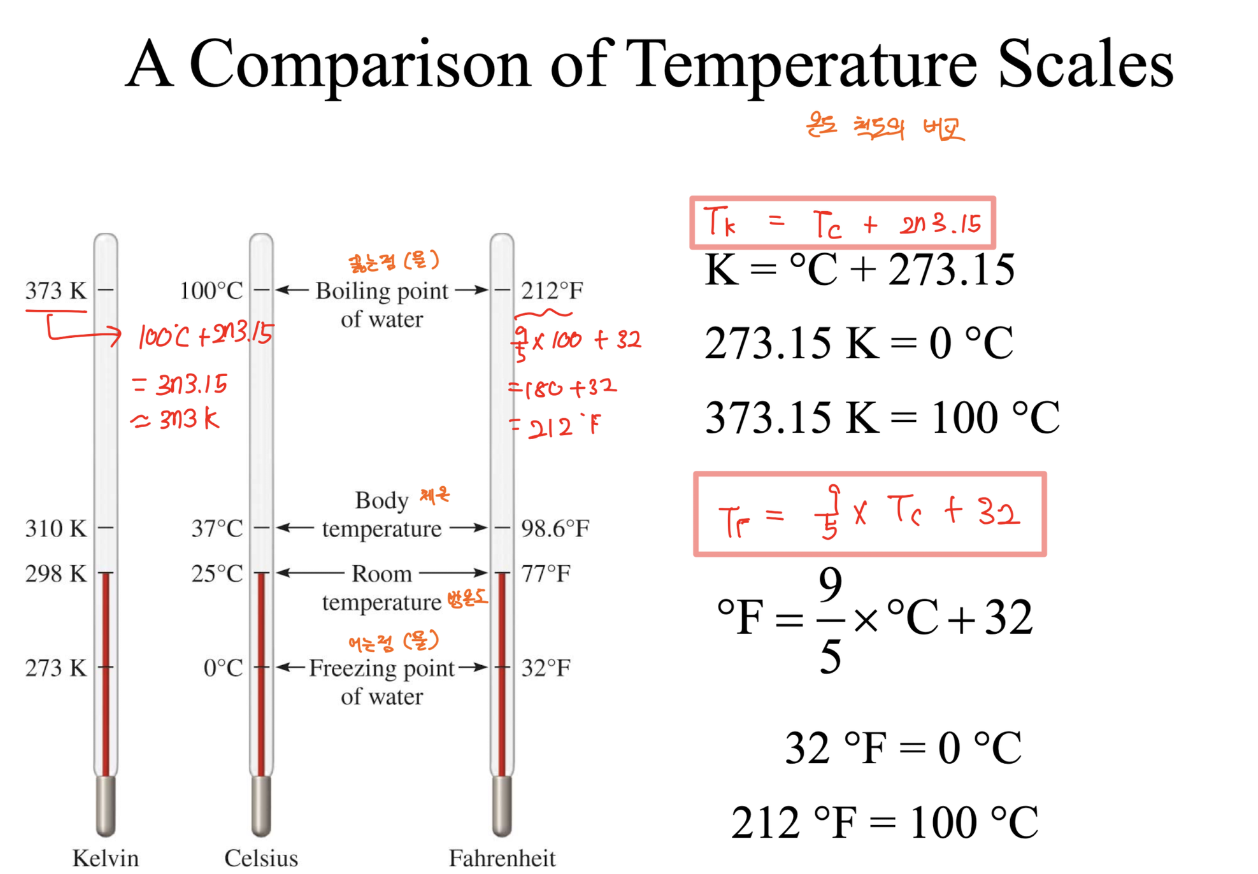
Kelvin 온도
- 공식 : Tk = Tc + 273.15
Fahrenheit 온도
- 공식 : Tf = (9/5 * Tc) + 32
Chemistry In Action 행동하는 화학

1.4 Handling Numbers
[1] Scientific Notation 과학적 표기법
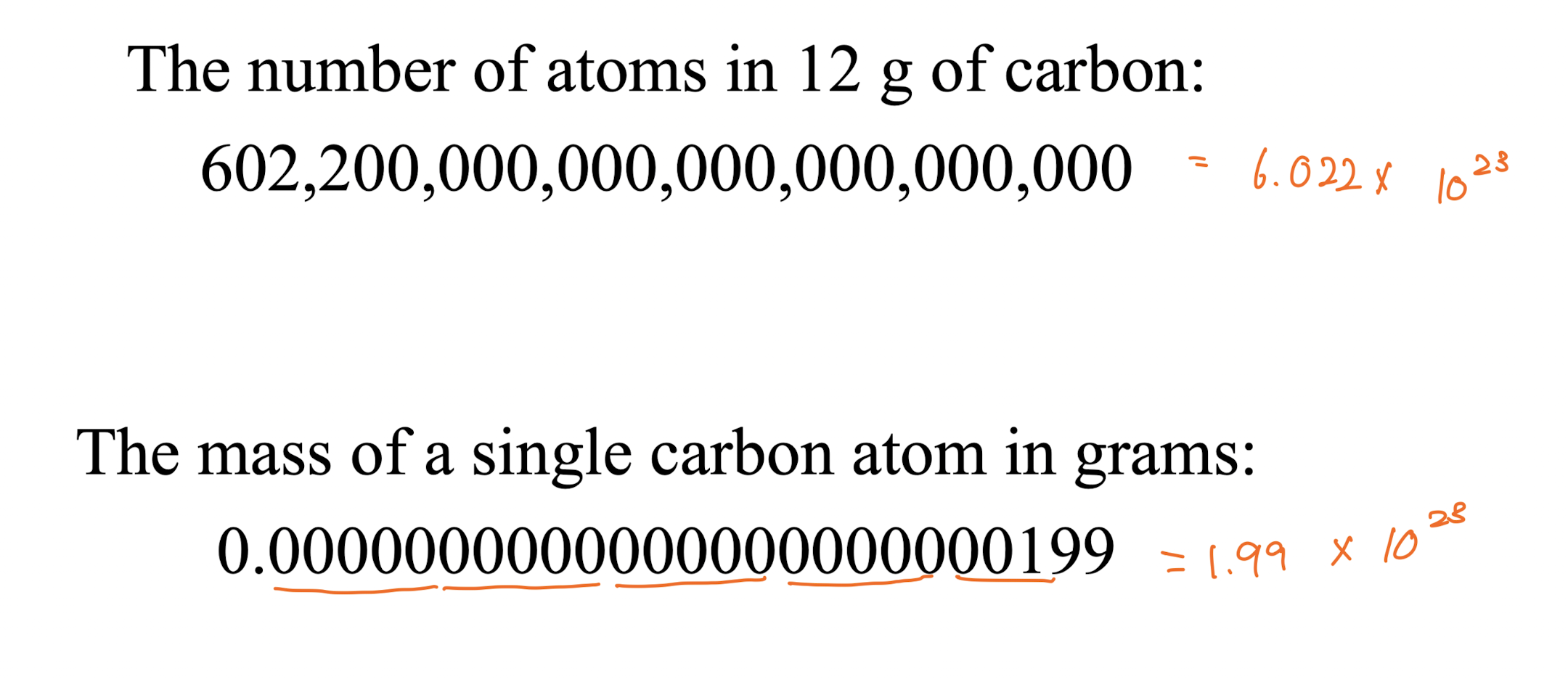
: 매우 큰 수나 매우 작은 수를 간단하게 표현하는 방법
[2] 첫 번째 규칙 (형식)
형식 : N = M * 10^E
- M : 1과 10 사이의
유효 숫자 - E : 지수
[3] 두 번째 규칙 (덧셈 또는 뺄셈)
방법
1) 지수 맞추기
2) 유효숫자 정렬 (유효숫자 부분 M을 더하거나 빼준다.)
예시

[4] 세 번째 규칙 (곱셈 또는 나눗셈)
방법
1) 유효숫자 곱하기
2) 지수 더하기
3) 정규화 (결과가 1이상 10미만으로 유지되도록 조정)
예시

[5] Significant Figures 유효숫자

: 측정값에서 실제로 의미 있는 숫자
전체 규칙

첫 번째 규칙 (덧셈 또는 밸셈)
: 소숫점 길이 중 짧은 길이에 맞춘다.
- 원래 숫자보다 소수점 오른 쪽에 더 많은 자릿수를 가질 수 없다.
- 예시

- 9.332의 경우 3개의 자릿수
- 1.1의 경우 1개의 자릿수
→ 따라서 90.432가 아닌 1개의 자릿수를 따라서 90.4(반올림)가 된다.
두 번째 규칙 (곱셈 또는 나눗셈)
: 유효 숫자가 적은 경우의 유효숫자 개수에 맞춘다.
- 결과의 유효 숫자 수는 유효 숫자 수가 가장 작은 원래 숫자로 설정된다.
- 예시
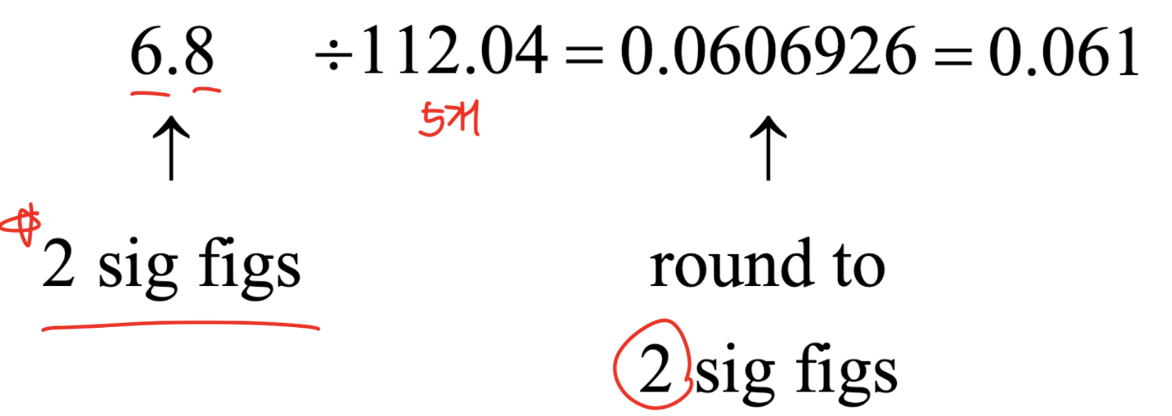
- 6.8의 경우 유효 숫자 2개
- 112.04의 경우 유효 숫자 5개
→ 따라서 0.0606926이 아닌 유효숫자 2개를 따라서 0.061 (반올림)이 된다.

728x90
'한동대학교 > 일반화학' 카테고리의 다른 글
| [일반 화학] Chapter 3 -(1) (0) | 2025.03.14 |
|---|---|
| [일반 화학] Chapter 2 - (3) (0) | 2025.03.14 |
| [일반 화학] Chapter 2 - (2) (0) | 2025.03.14 |
| [일반화학] Chapter 2 - (1) (0) | 2025.03.14 |
| [일반화학] Chapter 1 - (2) (0) | 2025.03.14 |





