Notice
Recent Posts
Recent Comments
Link
250x250
| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | ||||
| 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| 25 | 26 | 27 | 28 | 29 | 30 | 31 |
Tags
- 날마다 솟는 샘물
- QT
- CHEMISTRY
- 일반화학
- 찬양
- GLS
- 어노인팅
- typeScript
- 데이터베이스
- Database
- 남재창교수님
- 한동대학교
- SQLD
- dbms
- SQL
- 웹개발
- csee
- 화학
- 전산전자공학부
- 예배
- Software Engineering
- 프론트엔드
- FE
- 설교
- 날솟샘
- 묵상
- CCM
- 글로벌리더십학부
- 혼자공부하는sql
- 유태준교수님
Archives
- Today
- Total
멈추지 않는 기록
[일반 화학] Chapter 3 -(2) 본문
728x90
5. Percent Composition of Compounds (화합물 구성 비율)
[1] Percent Composition (구성 비율)
: Percent composition of an element in a compound (화합물 내 원소 구성 비율)

- n은 화합물 1 몰에서 원소의 몰 수이다.
1) 예시 (에탄올)
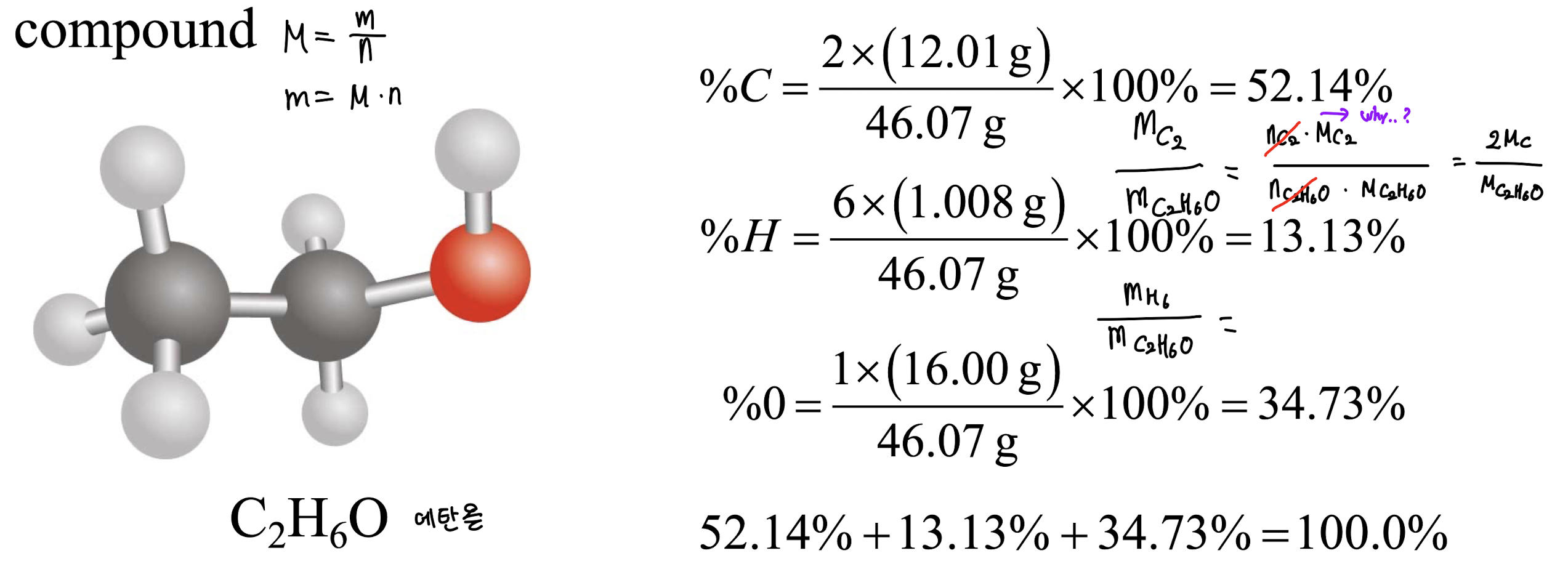
[2] 퍼센트 구성 및 경험적 공식

1) 질량 백분율 (Mass Percent)
- 질량 백분율은 화합물에서 특정 원소가 차지하는 질량의 비율을 백분율로 나타낸다.
- 계산 방법:
- 각 원소의 질량을 그 화합물의 전체 질량으로 나누고 100을 곱한다.
- (공식) 질량 백분율 = (원소의 질량 / 화합물의 총 질량) × 100
2) 각 원소의 몰 수 (Moles of Each Element)
- 질량 백분율을 사용하여 원소의 몰 수를 계산한다.
- 계산 방법:
- 질량 백분율을 g으로 변환한다 (예: 100 g의 화합물 기준으로).
- 각 원소의 질량을 원소의 몰 질량으로 나눈다.
- (공식) 몰 수 = 원소의 질량(g) / 원소의 몰 질량(g/mol)
3) 원소의 몰 비율 (Mole Ratios of Elements)
- 각 원소의 몰 수를 구한 후, 가장 작은 몰 수로 나누어 비율을 계산한다.
- 계산 방법:
- 각 원소의 몰 수를 가장 작은 몰 수로 나눈다.
- (공식) 비율 = 각 원소의 몰 수 / 가장 작은 몰 수
4) 정수화하여 첨자 변경 (Change to Integer Subscripts)
- 계산한 비율을 정수 형태로 바꾼다.
- 만약 비율이 정수가 아닐 경우, 비율의 최소 공배수를 곱하여 정수로 만든다.
5) 경험식 (Empirical Formula)
- 원소의 정수 비율을 기반으로 화합물의 경험식을 작성한다.

728x90
'한동대학교 > 일반화학' 카테고리의 다른 글
| [일반화학] Chapter 3 - (4) (0) | 2025.03.14 |
|---|---|
| [일반화학] Chapter 3 - (3) (0) | 2025.03.14 |
| [일반 화학] Chapter 3 -(1) (0) | 2025.03.14 |
| [일반 화학] Chapter 2 - (3) (0) | 2025.03.14 |
| [일반 화학] Chapter 2 - (2) (0) | 2025.03.14 |





