728x90
7. Chemical Reactions and Chemical Equations
[1-1] Chemical Reactions and Equations
: 화학 반응 및 방정식
chemical reaction: 하나 이상의 물질이 하나 이상의 새로운 물질로 변화하는 과정- chemical equation (화학 방정식)은 화학 기호를 사용하여 화학 반응 중 일어나는 일을 보여준다.
- reactants(반응물) -> products(물품)
1) ex) H₂와 O₂가 반응하여 H₂O를 형성하는 것을 표현하는 세 가지 방법
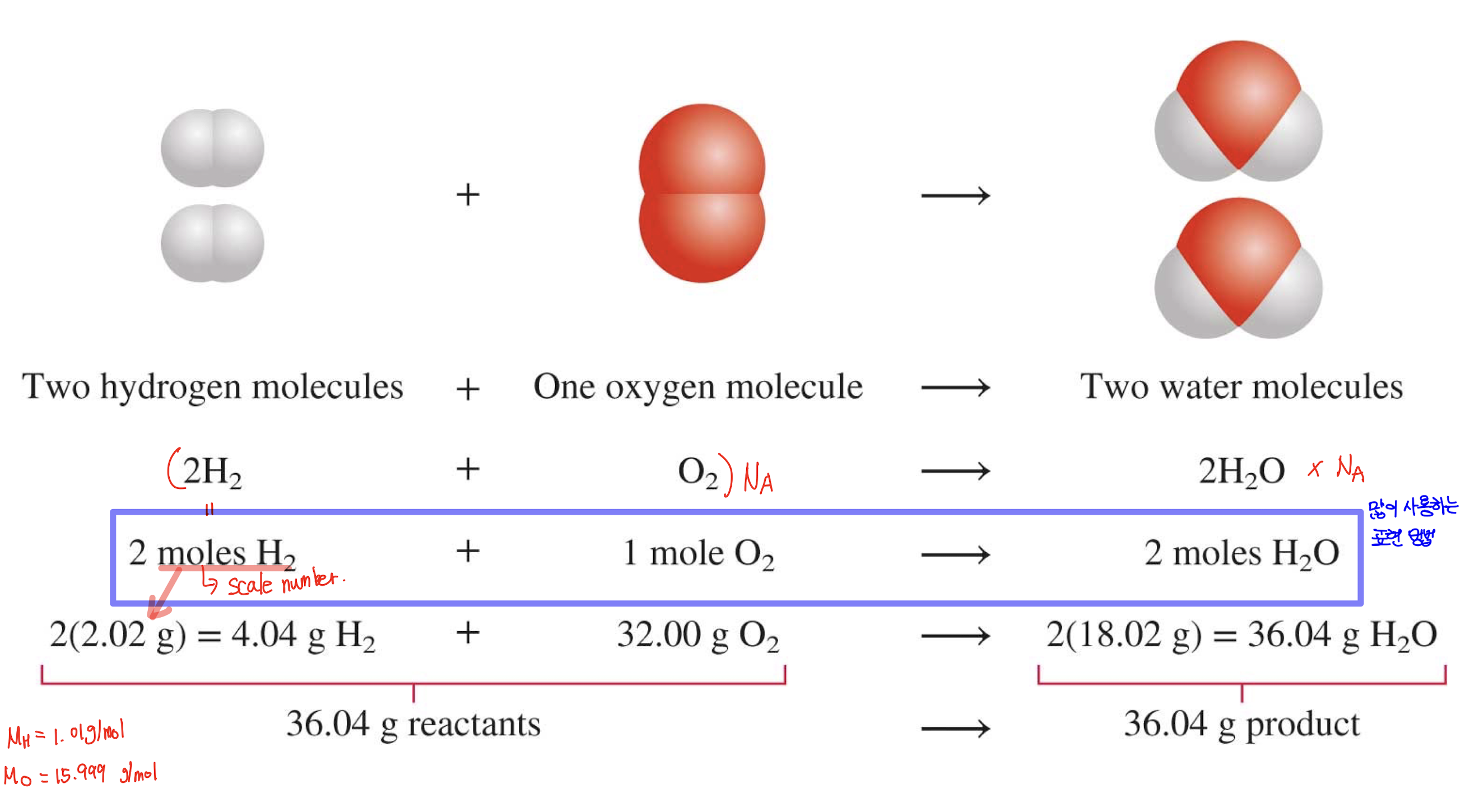
[2] 화학 방정식을 읽는 방법
- 예시 화학 방정식: 2Mg + O₂ → 2MgO
- 2개의 Mg 원자와 1개의 O₂ 분자가 2개의 MgO 화학식 단위를 만듭니다.
- 2몰의 Mg와 1몰의 O₂가 2몰의 MgO를 만듭니다.
- 48.6 그램의 Mg와 32.0 그램의 O₂가 80.6 그램의 MgO를 만듭니다.
- 잘못된 해석 예시 : "2 grmas Mg + 1 grams O₂ makes 2gram MgO"
[3-1] Balancing Chmeical Equations
: 화학 방정식 균형 맞추기
1) 올바른 화학식 작성
: 반응물(reactants)은 방정식의 왼쪽에, 생성물(products)은 오른쪽
에 작성
- 예시: 에탄(C₂H₆)이 산소(O₂)와 반응하여 이산화탄소(CO₂)와 물(H₂O)을 생성하는 반응
- C₂H₆ + O₂ → CO₂ + H₂O
2) 계수 조정
: 화학식 앞의 숫자(계수, coefficients)를 조정하여 각 원소의 원자 수를 양쪽에서 같게 만듦
- 첨자(subscripts)는 절대 변경하지 않음
- 예시
- 올바른 예: 2C₂H₆
- 잘못된 예: C₄H₁₂
3) 한 반응물과 한 생성물에만 나타나는 원소부터 균형 맞추기
: C와 H는 CO₂와 H₂O에서만 나타나므로, 이들부터 균형을 맞춤
- 예시
- 탄소(C) 균형: C₂H₆ + O₂ → 2CO₂ + H₂O
- 수소(H) 균형: C₂H₆ + O₂ → 2CO₂ + 3H₂O
4) 두 개 이상의 반응물이나 생성물에 나타나는 원소 균형 맞추기
: 산소(O)는 여러 화합물에 나타나므로 마지막에 균형을 맞춤
- 예시
- 오른쪽의 산소 원자 수: (2 × 2) + 3 = 7
- 왼쪽의 O₂에 7/2를 곱함: C₂H₆ + 7/2O₂ → 2CO₂ + 3H₂O
: 분수를 제거하기 위해 전체 방정식에 2를 곱함:
- 예시
- 2C₂H₆ + 7O₂ → 4CO₂ + 6H₂O
5) 최종 확인
: 방정식의 양쪽에서 각 원소의 원자 수가 같은지 확인

6) 추가 참고 사항
- 방정식 균형을 맞출 때는 가장 간단한 정수비를 사용
- 복잡한 방정식의 경우, 한 번에 모든 원소의 균형을 맞추기 어려울 수 있으므로 단계별로 접근
- 균형 잡힌 방정식은 질량 보존 법칙을 만족시키며, 반응물과 생성물 사이의 올바른 양적 관계를 나타냄
[3-2] 유태준 교수님 방식
- 올바른 화학식 작성
- C₂H₆ + O₂ → CO₂ + H₂O
- A(C₂H₆) + B(O₂) → C(CO₂) + D(H₂O)
- 각 원소에 대한 관계 생성
- C : 2A = 1C
- H : 6A = 2D
- O : 2B = 2C + 1D
- 관계를 통한 비율 생성
- A : A
- B : 7/2A
- C : 2A
- D = 3A
A : B : C : D = A : 7/2A : 2A : 3A = 2 : 7 : 4 : 6
- 이 비율을 작성
: 2(C₂H₆) + 7(O₂) → 4(CO₂) + 6(H₂O)
8. Amounts of Reactants and Products (반응물 및 생성물의 양)
[1] Amounts of Reactants and Products (반응물 및 생성물의 양)
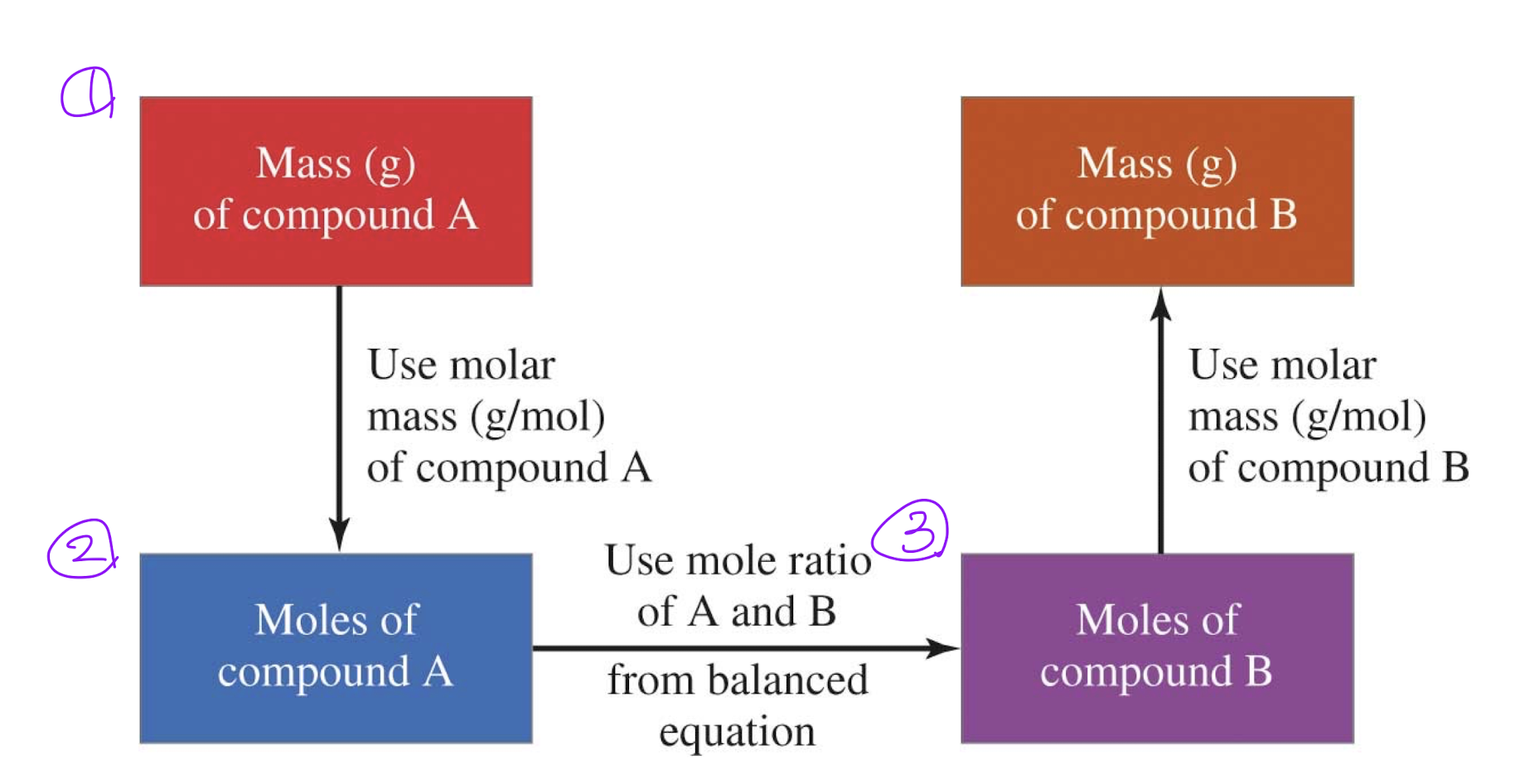
- 균형 잡힌 화학 방정식 작성하기
: 화학 반응에서 반응물과 생성물의 비율을 나타내기 위해 균형 잡힌 화학 방정식을 작성한다.
- *예시: * CH₄ + 2 O₂ → CO₂ + 2 H₂O
: 이 방정식은 메탄 (CH₄)이 산소 (O₂)와 반응하여 이산화탄소 (CO₂)와 물 (H₂O)을 생성하는 과정을 나타낸다.
- 알려진 물질의 양을 몰로 변환하기
: 반응물이나 생성물의 양이 주어졌을 때, 이를 몰 단위로 변환한다. 이때 몰 수는 물질의 질량(g)을 몰 질량(g/mol)으로 나누어 계산할 수 있다.
- 예시
: 만약 메탄의 양이 16g일 경우, 메탄의 몰 질량은 16g/mol이므로 몰 수 = 질량 / 몰 질량 = 16g / 16g/mol = 1 mol이다.
- 균형 방정식의 계수를 사용하여 구하고자 하는 양의 몰 수 계산하기
: 균형 잡힌 화학 방정식에서 계수를 활용하여 원하는 물질의 몰 수를 계산한다. 이 과정에서 주어진 반응물이나 생성물의 몰 수와 비례관계를 고려한다.
- 예시:
: 위의 반응식에서 CH₄ 1mol이 반응하면 CO₂가 1mol 생성된다. 따라서 메탄 1mol이 반응할 때 이산화탄소의 양은: CO₂ 몰 수 = 1 mol × (1 mol CO₂ / 1 mol CH₄) = 1 mol CO₂
- 구하고자 하는 물질의 몰을 원하는 단위로 변환하기
: 구해진 몰 수를 다시 원하는 단위 (예: g, L 등)로 변환한다. 이때는 몰 수에 해당 물질의 몰 질량 또는 분자량을 곱하여 계산한다.
- 예시:
: 이산화탄소의 몰 질량은 약 44g/mol이므로, 1mol의 이산화탄소는 질량 = 몰 수 × 몰 질량 = 1 mol × 44g/mol = 44g
따라서 메탄 16g이 반응하면 44g의 이산화탄소가 생성된다.

728x90
'🏫 한동대학교 > 일반화학' 카테고리의 다른 글
| [일반화학] Chapter 4 -(1) (0) | 2025.03.14 |
|---|---|
| [일반화학] Chapter 3 - (4) (0) | 2025.03.14 |
| [일반 화학] Chapter 3 -(2) (0) | 2025.03.14 |
| [일반 화학] Chapter 3 -(1) (0) | 2025.03.14 |
| [일반 화학] Chapter 2 - (3) (0) | 2025.03.14 |
