4.1 General Properties of Aqueous Solutions
: 수용액(solution)의 일반적인 특성
[1] Solutions
1) 종류
solution(용액): 두 가지 이상의 물질(substance)가 균일하게 섞인 혼합물(homogenous mixture)이다.- ex) 예를 들어 설탕물은 물과 설탕이 섞여서 만든 용액
solute(용질): 소량으로 존재하는 물질(substance)- ex) 설탕물의 경우, 설탕이 용질
- 용질은 용매에 의해 녹아서 용액을 만든다.
solvent(용매): 더 많은 양으로 존재하는 물질(substance)- ex) 설탕물의 경우, 물이 용매
[2-1] Electrolytes
1) 전해질 & 비전해질
- electrolyte(전해질) : 물에 녹으면, 전기를 전도할 수 있는 용액이 되는 물질(substance)
- nonelectrolyte(비전해질) : 물에 녹으면, 전기가 통하지 않는 용액을 만드는 물질(substance)
2) 강도에 따른 전해질
- Nonelectrolyte : 전기를 전도하지 않음 (설탕).
- Weak Electrolyte : 전기를 약하게 전도함 (아세트산).
S- trong Electrolyte : 전기를 강하게 전도함 (염화 나트륨).
[2-2] Electrolytes
0) Q. 용액(solution)에서 전기를 전도하지 않나요?
-> A. 양이온(cation)과 음이온(anion)이 있어야 한다. (용액에서 전기를 전도하려면 반드시 양이온(양전하)과 음이온(음전하) 같은 이온이 있어야 한다. 이 이온들이 전기를 운반하며 전도성을 부여한다.)

1) Strong Electrolyte (강한 전해질)
- 강한 전해질은 물에 녹으면 완전히 이온화되어, 모든 분자가 이온으로 분리된다.
- 예시 : NaCl(염화 나트륨)
물에서 Na⁺(aq)와 Cl⁻(aq)로 완전히 분리됩니다.
2) Weak Electrolyte (약한 전해질):
- 약한 전해질은 물에 녹아도 일부만 이온화된다.
- 모든 분자가 이온으로 분리되지 않고, 대부분은 원래 형태를 유지한다.
- 예시 : CH₃COOH(아세트산)
물에서 CH₃COO⁻(aq)와 H⁺(aq)로 일부만 이온화된다.
3) 정리
: 강한 전해질은 물에서 완전히 분리되어 전기를 잘 전도하는 반면, 약한 전해질은 부분적으로만 분리되어 전도성이 약하다.
[2-3] Electrolytes
1) 아세트산의 이온화 (Ionization)
가역 반응 (Reversible Reaction)- 화살표
(⇌)는 가역 반응을 나타낸다.
(반응이 양방향으로 일어날 수 있다는 것을 의미) - 즉, 아세트산이
물에서 부분적으로 이온화되어 CH₃COO⁻(aq)와 H⁺(aq)로 나뉘지만, 다시 CH₃COOH로 돌아갈 수 있다는 뜻이다.
- 화살표
약한 전해질 (Weak Electrolyte)
- 아세트산은 약한 전해질로 분류된다.
(이는 물에 녹았을 때완전히 이온화되지 않고 일부만 이온화된다는 의미이다) - 아세트산의 이온화가 불완전하다.
- 즉,
모든 분자가 이온으로 분리되지 않고 상당수의 분자는 여전히 CH₃COOH 형태로 남아있기 때문이다.
- 즉,
- 아세트산은 약한 전해질로 분류된다.
2) 정리
: 정리하자면, 아세트산은 물에서 완전히 이온화되지 않고 일부는 이온화되고, 일부는 다시 원래 분자로 돌아가는 가역적인 약한 전해질이다.
[2-4] Electrolytes
0) Q. 비전해질(Nonelecrolyte)는 전기를 전도하지 않나요?
-> A. 비전해질의 용액(solution)에는 양이온(cation)과 음이온(anion)이 없어서 전류가 흐르지 않는다. (비전해질은 용액 속에서 이온을 생성하지 않기 때문에 전기를 전도하지 않는다.)
1) 예시
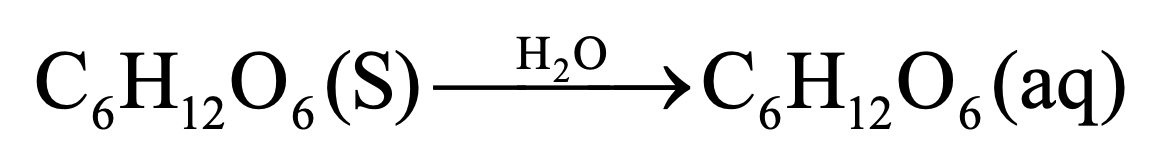
2) 수용액의 용질 분류
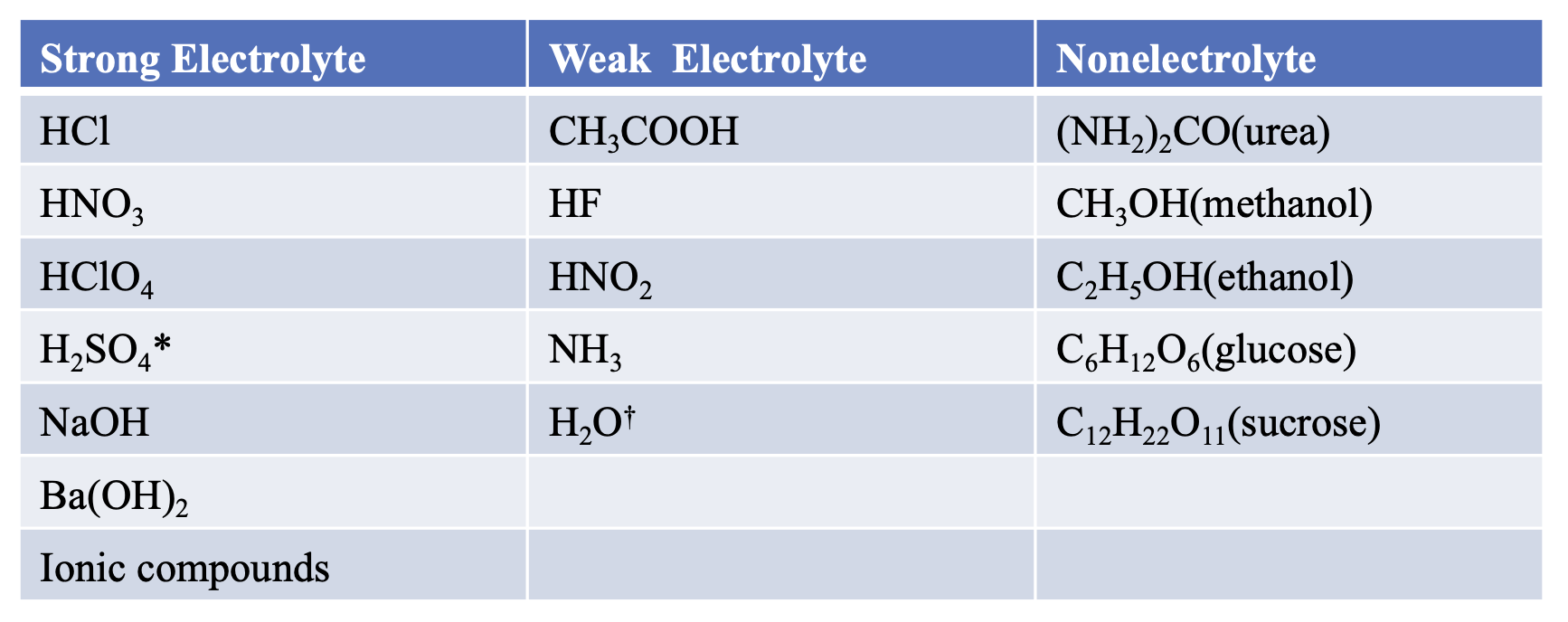
- H2SO4는 이온화 가능한 H+의 이온이 두 개 있지만, 그 중 하나만 완전히 이온화된다.
- 순수한 물은 매우 약한 전해질이다.
[3] Hydration
1) Hydration (수화)
: 이온이 특정 방식으로 배열된 물 분자에 둘러싸여 있는 과정을 말한다.
2. Precipitation Reactions (침전 반응)
[1] Precipitation Reactions (침전 반응)
: 두 개의 용액이 섞였을 때, 그 결과로 고체 침전물이 생성되는 화학 반응을 의미한다.
1) Precipitate (침전)
: 용액(solution)에서 분리되는 불용성 고체(insoluble solid)
- 불용성 고체 : 물에 녹지 않거나 매우 적게 녹는 고체를 의미한다.
- 이 고체는 용매인 물과 섞일 때, 고체 상태로 남아 있으며 용액을 형성하지 않는다.
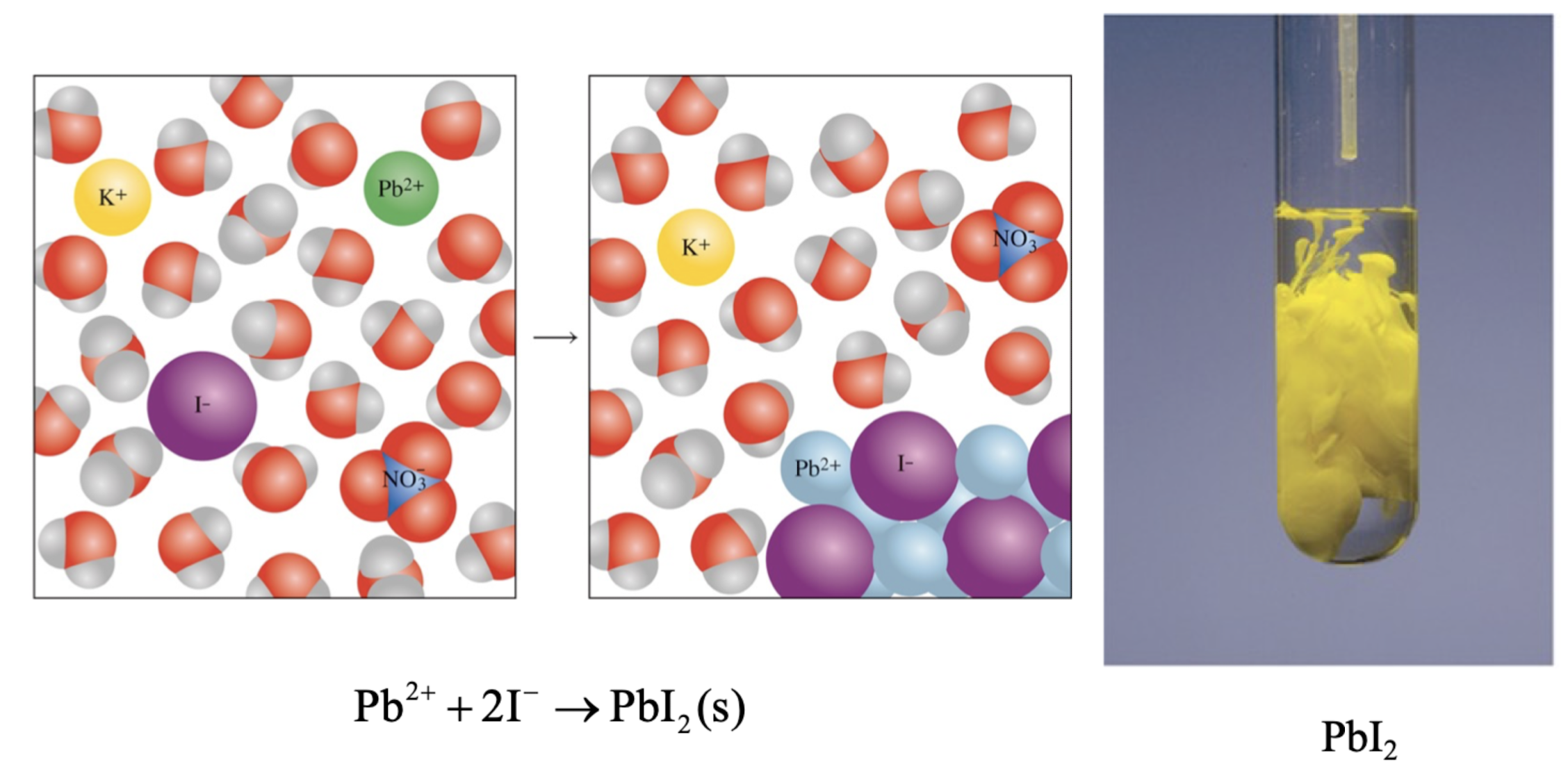
2) 예시 : PbI2 <요오드화납(II)>의 침전

- molecular equation (분자 방정식)
: 반응물과 생성물을 분자 형태로 나타낸 방정식
-> Pb(NO₃)₂(aq) + 2NaI(aq) → PbI₂(s) + 2NaNO₃(aq)
- ionc equation (이온 방정식)
: 수용액 상태의 화합물을 이온으로 분리하여 나타낸 방정식
-> Pb²⁺ + 2NO₃⁻ + 2Na⁺ + 2I⁻ → PbI₂(s) + 2Na⁺ + 2NO₃⁻
- net ionic equation (순 이온 방정식)
: 실제로 반응에 참여하는 이온만을 나타낸 방정식
-> Pb²⁺ + 2I⁻ → PbI₂(s)
- Spectator ions (구경꾼 이온)
: 반응에 직접 참여하지 않는 이온
-> Na⁺와 NO₃⁻
- 사진으로 보는 모습
[2] Solubility (용해도)
: 특정 온도에서 주어진 양의 용매에 용해되는 용질의 최대양을 의미한다.
-> 온도와 용매의 양이 용해도에 영향을 미친다.
1) 25°C의 물에서 일반적인 이온 화합물에 대한 용해도 규칙
: 이 표는 화학자들이 화합물의 용해도를 빠르게 예측하는 데 사용하는 일반적인 규칙을 제공하며,예외 사항들은 일반 규칙에 맞지 않는 특별한 경우를 나타낸다.
-> 이러한 규칙은 화학 반응, 특히 침전 반응을 예측하는 데 매우 유용하다.
수용성 화합물 (Soluble Compounds):
- 알칼리 금속 이온(Li⁺, Na⁺, K⁺, Rb⁺, Cs⁺)을 포함한 화합물
- 암모늄 이온(NH₄⁺)을 포함한 화합물
- 질산염(NO₃⁻), 아세트산염(CH₃COO⁻), 중탄산염(HCO₃⁻), 염소산염(ClO₃⁻), 과염소산염(ClO₄⁻)
- 할로겐화물(Cl⁻, Br⁻, I⁻)
- 황산염(SO₄²⁻)
불용성 예외 (Insoluble Exceptions):
- Ag⁺, Hg₂²⁺, Pb²⁺의 할로겐화물
- Ag⁺, Ca²⁺, Sr²⁺, Ba²⁺, Hg²⁺, Pb²⁺의 황산염
불용성 화합물 (Insoluble Compounds):
- 탄산염(CO₃²⁻), 인산염(PO₄³⁻), 크로메이트(CrO₄²⁻), 황화물(S²⁻)
수산화물(OH⁻)
- 탄산염(CO₃²⁻), 인산염(PO₄³⁻), 크로메이트(CrO₄²⁻), 황화물(S²⁻)
수용성 예외 (Soluble Exceptions):
- 알칼리 금속 이온과 암모늄 이온을 포함한 화합물
- Ba²⁺ 이온을 포함한 화합물
2) 표로 보는 부분

- 수용성 화합물 (Soluble Compounds):
- 알칼리 금속 이온 (Li⁺, Na⁺, K⁺, Rb⁺, Cs⁺)
- 암모늄 이온 (NH₄⁺)
- 질산염 (NO₃⁻)
- 아세트산염 (CH₃COO⁻)
- 중탄산염 (HCO₃⁻)
- 염소산염 (ClO₃⁻)
- 과염소산염 (ClO₄⁻)
- 할로겐화물 (Cl⁻, Br⁻, I⁻)
- 황산염 (SO₄²⁻)
- 불용성 예외 (Insoluble Exceptions):
- Ag⁺, Hg₂²⁺, Pb²⁺의 할로겐화물
- Ag⁺, Ca²⁺, Sr²⁺, Ba²⁺, Hg²⁺, Pb²⁺의 황산염
- 불용성 화합물 (Insoluble Compounds):
- 탄산염 (CO₃²⁻)
- 인산염 (PO₄³⁻)
- 크로메이트 (CrO₄²⁻)
- 황화물 (S²⁻)
- 수산화물 (OH⁻)
- 수용성 예외 (Soluble Exceptions):
- 알칼리 금속 이온을 포함한 화합물
- 암모늄 이온을 포함한 화합물
- Ba²⁺ 이온을 포함한 화합물
3) Insoluble Compounds의 예시


'🏫 한동대학교 > 일반화학' 카테고리의 다른 글
| [일반화학] Chapter 4 - (3) (0) | 2025.03.14 |
|---|---|
| [일반화학] Chapter 4 -(2) (0) | 2025.03.14 |
| [일반화학] Chapter 3 - (4) (0) | 2025.03.14 |
| [일반화학] Chapter 3 - (3) (0) | 2025.03.14 |
| [일반 화학] Chapter 3 -(2) (0) | 2025.03.14 |
