| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| 29 | 30 |
- CCM
- 프론트엔드
- dbms
- 날솟샘
- SQLD
- 한동대학교
- 유태준교수님
- csee
- 혼자공부하는sql
- Software Engineering
- 예배
- 날마다 솟는 샘물
- FE
- 글로벌리더십학부
- Database
- 데이터베이스
- 전산전자공학부
- 설교
- 남재창교수님
- 웹개발
- 어노인팅
- 일반화학
- GLS
- typeScript
- 찬양
- CHEMISTRY
- SQL
- 묵상
- QT
- 화학
- Today
- Total
멈추지 않는 기록
[일반화학] Chapter 4 - (3) 본문
[3-1] 산화 번호 (Oxidation Number)
: 산화 번호는 화합물에서 각 원자가 가질 수 있는 전하 상태를 나타낸다.
- 이는 화합물 내에서 전자의 이동을 이해하고, 산화·환원 반응을 분석하는 데 중요한 개념이다.
1) 자유 원소의 산화 번호는 0이다.
- 결합되지 않은 상태의 원소들은 산화 번호가 0이다.
- 예시: Na, O₂, H₂, N₂ 등
2) 단원자 이온에서 산화 번호는 이온의 전하와 같다.
- 단일 원자로 구성된 이온의 산화 번호는 이온의 전하와 같다.
- 예시:
- Li⁺ → 산화 번호: +1
- Fe³⁺ → 산화 번호: +3
- O²⁻ → 산화 번호: -2
- 예시:
3) 산소의 산화 번호는 일반적으로 -2이다.
- 대부분의 화합물에서 산소는 산화 번호가 -2이지만, 예외도 있다.
- 예시: H₂O₂(과산화수소)에서 산소의 산화 번호는 -1이다.
4) 수소의 산화 번호는 금속과 결합한 경우를 제외하고 +1이다.
- 일반적으로 수소는 +1이지만, 금속과 결합한 경우는 -1이 된다.
- 예시:
- HCl에서 수소의 산화 번호는 +1
- NaH(수소화 나트륨)에서 수소의 산화 번호는 -1
- 예시:
5) 1족 원소는 +1, 2족 원소는 +2, 플루오린은 -1이다.
- 1족 원소: +1
- 2족 원소: +2
- 플루오린: -1
- 예시:
- NaCl에서 Na는 +1, Cl은 -1
- CaO에서 Ca는 +2, O는 -2
- 예시:
6) 분자 또는 이온의 산화 번호 합은 그 분자 또는 이온의 전하와 같다.
- 모든 원자의 산화 번호 합은 분자의 전하와 일치한다.
- 예시:
- H₂O에서 산화 번호의 합: 0 (H: +1 x 2, O: -2 → 총합 0)
- SO₄²⁻에서 산화 번호의 합: -2 (S: +6, O: -2 x 4 → 총합 -2)
- 예시:
7) 산화 번호는 정수일 필요는 없다.
- 일부 화합물에서 산화 번호는 분수일 수 있다.
- 예시: O₂²⁻ (과산화물 이온)에서 산소의 산화 번호는 -1/2
[3-2] The Oxidation Numbers of Elements in their Compounds
: 화합물에 포함된 원소의 산화 번호

[ 주요 키포인트 ]
- 1, 2족은 산화 번호가 항상 고정이다
- 보통 산소는 산화 번호를 -2로 사용한다.
[4] Type of Oxidation-Reduction Reactions
: 산화-환원 반응의 유형
1) Combination Reaction (조합 반응)
: 두 개 이상의 물질(A, B)이 결합하여 하나의 물질(C)을 형성하는 반응.
- 일반식: A + B -> C
- 예시:
- 2H₂ + O₂ -> 2H₂O (수소와 산소가 결합하여 물을 형성)
2) Decomposition Reaction (분해 반응)
: 하나의 물질(C)이 분해되어 두 개 이상의 물질(A, B)로 나누어지는 반응.
- 일반식: C -> A + B
- 예시:
- 2H₂O -> 2H₂ + O₂ (물이 분해되어 수소와 산소가 생성)
3) Combustion Reaction (연소 반응)
: 산소(O₂)와 결합하여 열과 빛을 방출하는 반응. 대부분의 연소 반응은 산화-환원 반응의 일종입니다.
- 일반식: A + O₂ -> B
- 예시:
- CH₄ + 2O₂ -> CO₂ + 2H₂O (메테인의 연소 반응)
4) Displacement Reaction (치환 반응)
: 하나의 원소(A)가 화합물(BC) 내의 다른 원소(B)를 치환하여 새로운 화합물(AC)과 원소(B)를 생성하는 반응.
- 일반식: A + BC -> AC + B
- 예시:
- Zn + CuSO₄ -> ZnSO₄ + Cu (아연이 구리를 치환하는 반응)
(1) Hydrogen Displacement (수소 치환)
: 금속이 산과 반응하여 수소를 치환하고, 그 결과 수소가 기체로 방출됩니다.
- 예시:
- Zn + 2HCl -> ZnCl₂ + H₂ (아연이 염산과 반응하여 수소 기체가 방출)
(2) Metal Displacement (금속 치환)
: 한 금속이 다른 금속 이온을 치환하여 새로운 금속을 생성합니다.
- 예시:
- Fe + CuSO₄ -> FeSO₄ + Cu (철이 구리 이온을 치환)
(3) Halogen Displacement (할로겐 치환)
: 더 반응성이 큰 할로겐이 다른 할로겐 이온을 치환하는 반응.
- 예시:
- Cl₂ + 2KBr -> 2KCl + Br₂ (염소가 브로민을 치환)
5) 불균등화 반응 (Disproportionation Reaction):
- 같은 원소가 동시에 산화되고 환원되는 반응이다.
- 예: Cl₂ + 2OH⁻ → ClO⁻ + Cl⁻ + H₂O
- 이 반응에서 Cl의 산화수는 0에서 +1(ClO⁻)과 -1(Cl⁻)로 변화한다.
[5] The Activity Series for Metals
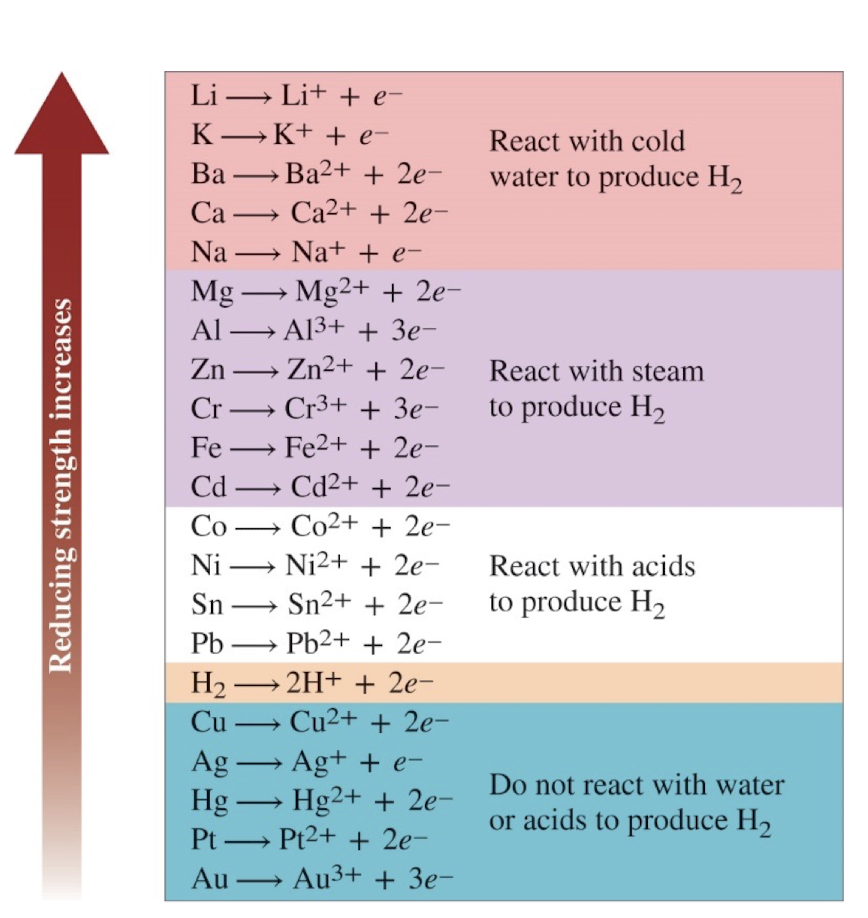
1) 금속의 활성도 계열 (The Activity Series for Metals)
: 금속들의 반응성을 나타내는 순서이다.
- 위쪽에 있는 금속일수록 반응성이 높고, 아래로 갈수록 반응성이 낮아진다.
- Li, K, Ba 등은
차가운 물과 반응하여 수소를 발생시킨다. - Zn, Cr, Fe 등은
수증기와 반응하여 수소를 발생시킨다. - Ni, Sn, Pb 등은
산과 반응하여 수소를 발생시킨다. - Cu, Ag, Au 등은
물이나 산과 반응하지 않는다.
2) 수소 치환 반응 (Hydrogen Displacement Reaction)
- 일반식: M + BC → MC + B (M은 금속, BC는 산 또는 물, B는 수소)
- 예: Ca + 2H₂O → Ca(OH)₂ + H₂
- 반응성이 높은 금속은 물이나 산의 수소를 치환할 수 있다.
[6] The Activity Series for Halogens
: 할로겐의 활성도 계열
- 반응성 순서: F₂ > Cl₂ > Br₂ > I₂
- 왼쪽에 있는 할로겐일수록 반응성이 높다.
1) 할로겐 치환 반응 (Halogen Displacement Reaction)
- 더 반응성이 큰 할로겐이 덜 반응성인 할로겐을 치환합니다.
- 예: Cl₂ + 2KBr → 2KCl + Br₂
- I₂는 가장 반응성이 낮아 다른 할로겐 화합물과 반응하지 않습니다.
4.5 Concentration of Solutions (용액의 농도)
[1] Solution Stoichiometry (용액 화학량론)
: 용액의 농도는 주어진 양의 용매 또는 용액에 존재하는 용질의 양을 나타냅니다. 농도는 다양한 방식으로 표현될 수 있으며, 일반적으로 몰 농도(Molarity, M)를 사용합니다. 몰 농도는 용액 1리터당 용질의 몰 수로 정의됩니다.
일반식:
M = (용질의 몰 수) / (용액의 부피 (리터))예시: 2몰의 NaCl을 1리터의 물에 녹이면 그 용액의 농도는 2M입니다.
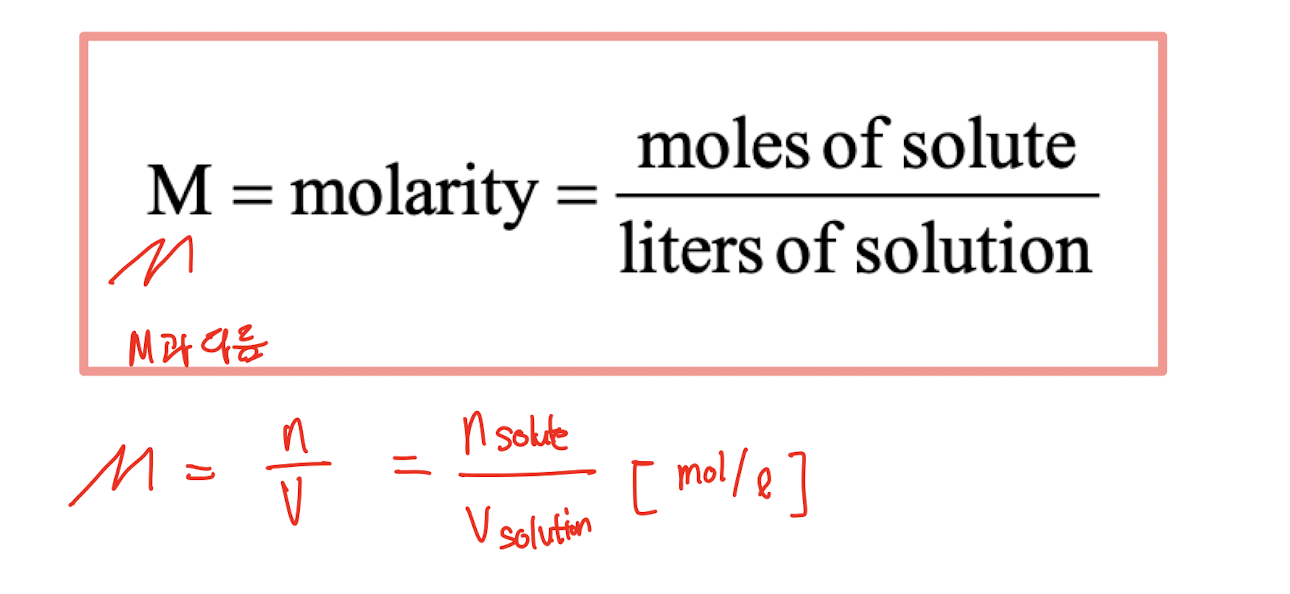
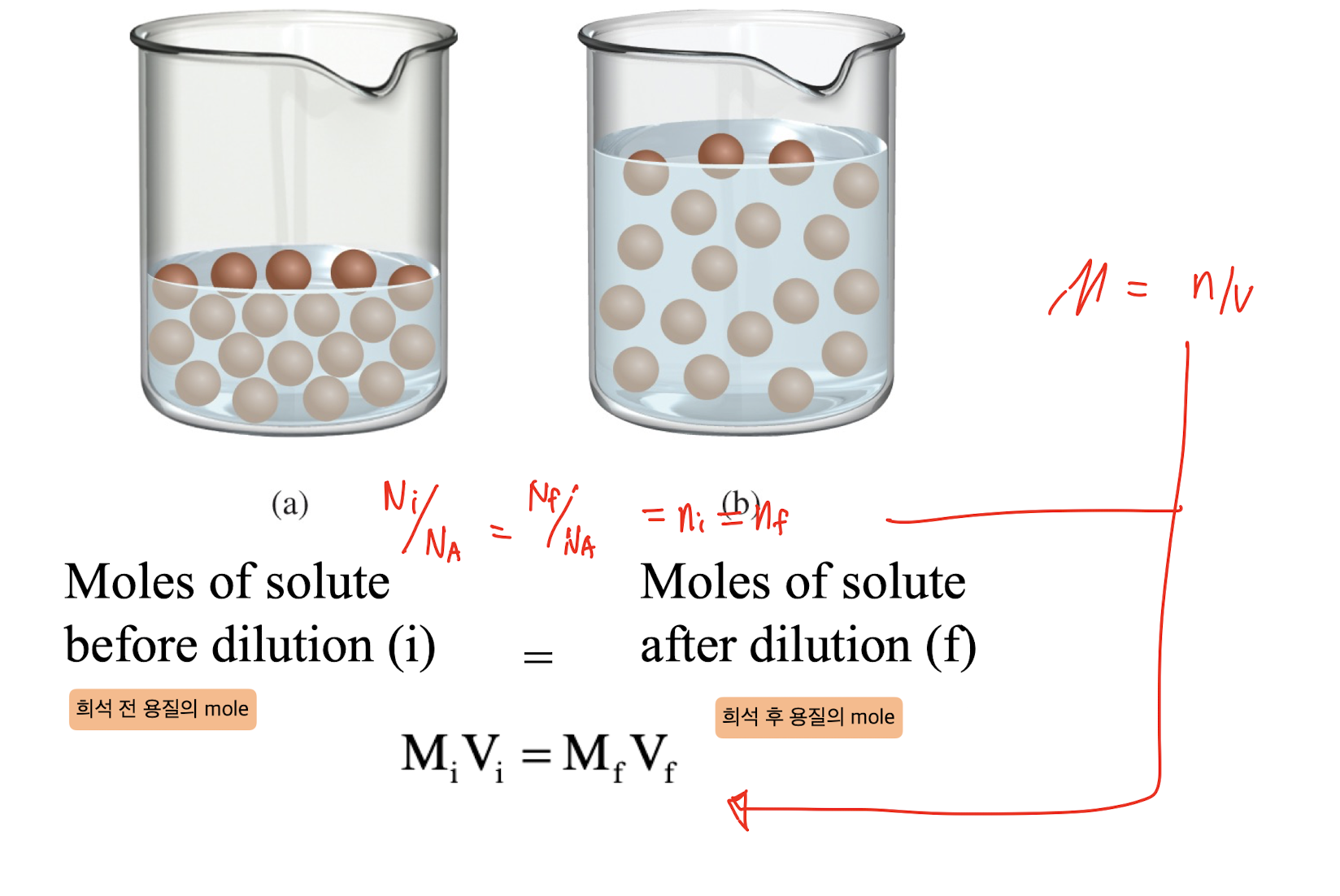
[2] Dilution (희석)
: 희석은 농도가 높은 용액을 일정량의 용매와 혼합하여 농도가 낮은 용액을 만드는 과정입니다. 희석 과정에서는 용질의 총량은 변하지 않지만 농도가 낮아집니다. 일반적으로 희석 공식은 다음과 같습니다:
일반식:
M₁ V₁ = M₂ V₂여기서,
- M₁: 원래 용액의 몰 농도
- V₁: 원래 용액의 부피
- M₂: 희석된 용액의 몰 농도
- V₂: 희석된 용액의 부피
예시: 1M의 NaCl 용액 50mL를 물로 100mL로 희석하면, 새로운 용액의 농도는 0.5M가 됩니다.
4.6 Gravimetric Analysis (중량 분석)
[1] Gravimetric Analysis (중량 분석법)
: 화학적 분석 방법 중 하나로, 물질의 양을 그 무게를 측정하여 결정하는 방법.
1) 주요 단계
- 미지 물질을 물에 용해시킨다.
: 이는 분석하고자 하는 물질을 용액 상태로 만드는 과정이다. - 미지 물질을 알려진 물질과 반응시켜 침전물을 형성시킨다.
: 이 단계에서 분석 대상 이온이 불용성 화합물로 변환된다. - 침전물을 여과하고 건조시킨다.
: 생성된 침전물을 용액으로부터 분리하고, 수분을 제거한다. - 침전물의 무게를 측정한다.
: 정밀한 저울을 사용하여 건조된 침전물의 질량을 측정한다. - 화학식과 침전물의 질량을 이용하여 미지 이온의 양은 결정한다.
: 측정된 질량과 화학량론적 계산을 통해 원래 용액 중 분석 대상 이온의 양을 계산한다.

'한동대학교 > 일반화학' 카테고리의 다른 글
| [일반 화학] Chapter 5 - (2) (0) | 2025.03.14 |
|---|---|
| [일반 화학] Chapter 5 - (1) (0) | 2025.03.14 |
| [일반화학] Chapter 4 -(2) (0) | 2025.03.14 |
| [일반화학] Chapter 4 -(1) (0) | 2025.03.14 |
| [일반화학] Chapter 3 - (4) (0) | 2025.03.14 |





