| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| 29 | 30 |
- 찬양
- 묵상
- FE
- csee
- GLS
- Software Engineering
- dbms
- 유태준교수님
- 프론트엔드
- 남재창교수님
- 한동대학교
- 일반화학
- 혼자공부하는sql
- 글로벌리더십학부
- 데이터베이스
- 소프트웨어공학
- CHEMISTRY
- 어노인팅
- 날솟샘
- SQL
- 날마다 솟는 샘물
- 전산전자공학부
- 웹개발
- Database
- QT
- SQLD
- CCM
- 화학
- 설교
- 예배
- Today
- Total
멈추지 않는 기록
[일반화학] Chapter 6 - (1) 본문
6.1 에너지의 본질과 에너지의 종류
[1] 에너지
: 에너지는 일을 할 수 있는 능력이다.
1) 종류
복사 에너지 (Radiant energy)
: 태양에서 나오는 에너지로 지구의 주요 에너지원이다.열 에너지 (Thermal energy)
: 원자와 분자의 무작위 운동과 관련된 에너지이다.화학 에너지 (Chemical energy)
: 화학 물질의 결합 내에 저장된 에너지이다.핵 에너지 (Nuclerar energy)
: 원자의 중성자와 양성자 집합 내에 저장된 에너지이다.위치 에너지 (Potential energy)
: 물체의 위치에 따라 사용할 수 있는 에너지이다.
6.2 화학 반응의 에너지 변화
: $ΔU = U_2 - U_1$
[1] 화학 반응의 에너지 변화
1) 화학 반응의 에너지 변화 열
: 서로 다른 온도에 있는 두 물체 사이에 열 에너지가 전달되는 것을 말한다.
- 관계식:
- $\propto \Delta U$ (내부 에너지 변화에 비례)
- $\propto \Delta T$ (온도 변화에 비례)
- 온도는 열 에너지의 척도이다.
2) 열역학 공식 (내부 에너지의 변화)
$\Delta U = U_2 - U_1 = U_{final} - U_{initial} = U_{product} - U_{reactant}$
3) 열전달 방향 (열역학 제2법칙)
- $T_1$과 $T_2$ 사이의 열전달:
- 조건 1: 만약 $T_1 > T_2$ 이면, 열은 $T_1$에서 $T_2$로 이동
- 조건 2: 만약 $T_2 > T_1$ 이면, 열은 $T_2$에서 $T_1$로 이동
- 열은 항상 높은 온도에서 낮은 온도로 자발적으로 이동한다.
[2] 열화학 (Thermochemistry)
: 열화학은 화학반응의 열 변화를 연구하는 학문이다.
1) system
: 열화학 연구에서 관심을 갖는 우주의 특정 부분
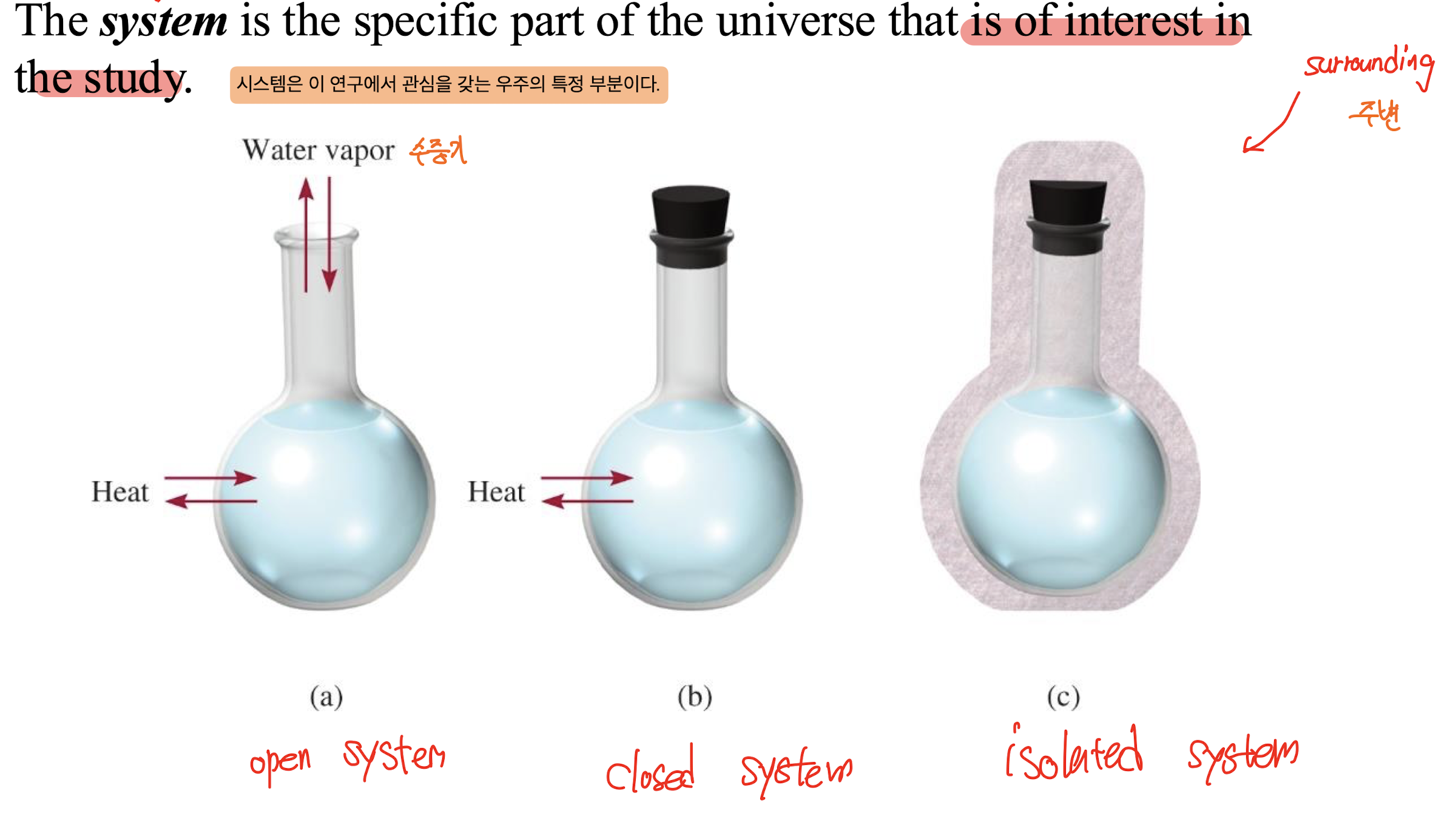
- open system (개방된 경우)
- closed system (폐쇠된 경우)
- isolated system (격리된 경우)
[3] 발열 및 흡열 과정 (Exothermic and Endothermic Processes)
1) 발열 과정
: 열을 방출하는 모든 프로세스로, system에서 surround로 열 에너지를 전달한다.
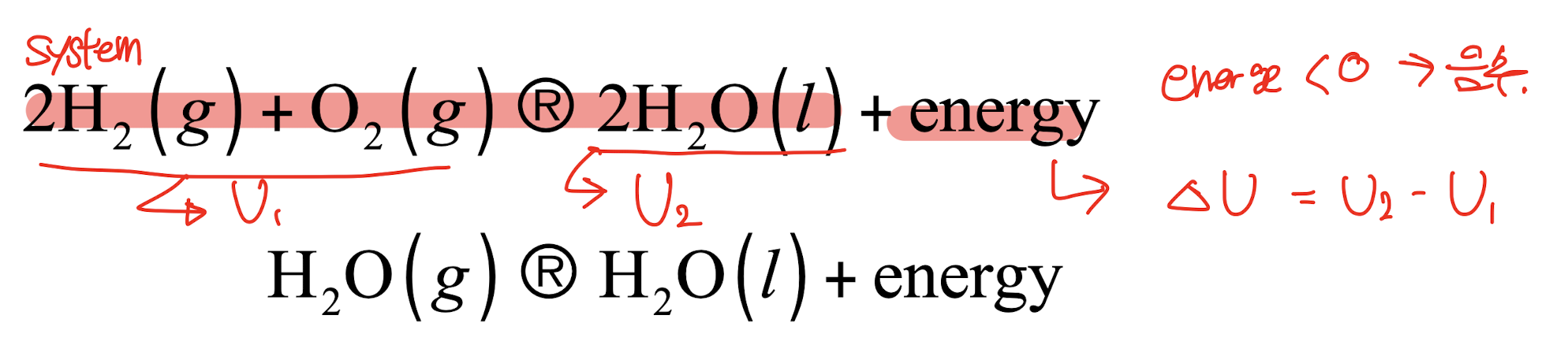
- 정의
- 시스템에서 주변으로 열 에너지를 전달하는 과정
- 열을 방출하는 모든 프로세스
- 특징
- $\Delta U = U_2 - U_1$ 에서 $\Delta U < 0$ (음수)
- 에너지가 시스템 밖으로 방출됨
- 예시 반응
- 수소와 산소의 반응: $2H_2(g) + O_2(g) \rightarrow 2H_2O(l) + energy$
수증기의 응축: $H_2O(g) \rightarrow H_2O(l) + energy$
- 수소와 산소의 반응: $2H_2(g) + O_2(g) \rightarrow 2H_2O(l) + energy$
2) 흡열 과정
: surround 환경에서 system으로 열을 공급해야 하는 모든 프로세스이다.
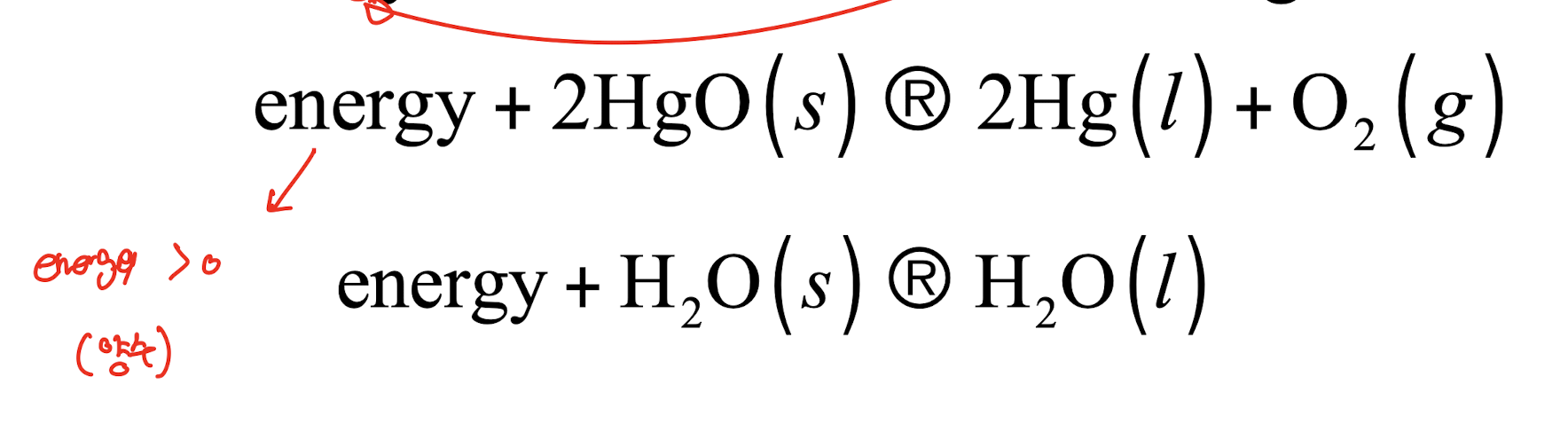
정의
- 주변 환경에서 시스템으로 열을 공급받는 과정
- 외부로부터 열을 흡수하는 모든 프로세스
특징
- $\Delta U = U_2 - U_1$ 에서 $\Delta U > 0$ (양수)
- 에너지가 시스템 안으로 흡수됨
예시 반응
- 산화수은의 분해: $energy + 2HgO(s) \rightarrow 2Hg(l) + O_2(g)$
- 얼음의 용해: $energy + H_2O(s) \rightarrow H_2O(l)$
3) 중요 포인트
상태 표시:
- (g): 기체 상태
- (l): 액체 상태
- (s): 고체 상태
에너지 방향:
- 발열 과정: 시스템 → 주변
- 흡열 과정: 주변 → 시스템
시스템과 주변(System and Surroundings):
- 시스템: 관찰하고자 하는 물질이나 반응이 일어나는 부분
- 주변: 시스템을 둘러싸고 있는 환경
[4] 발열 및 흡열 회로도
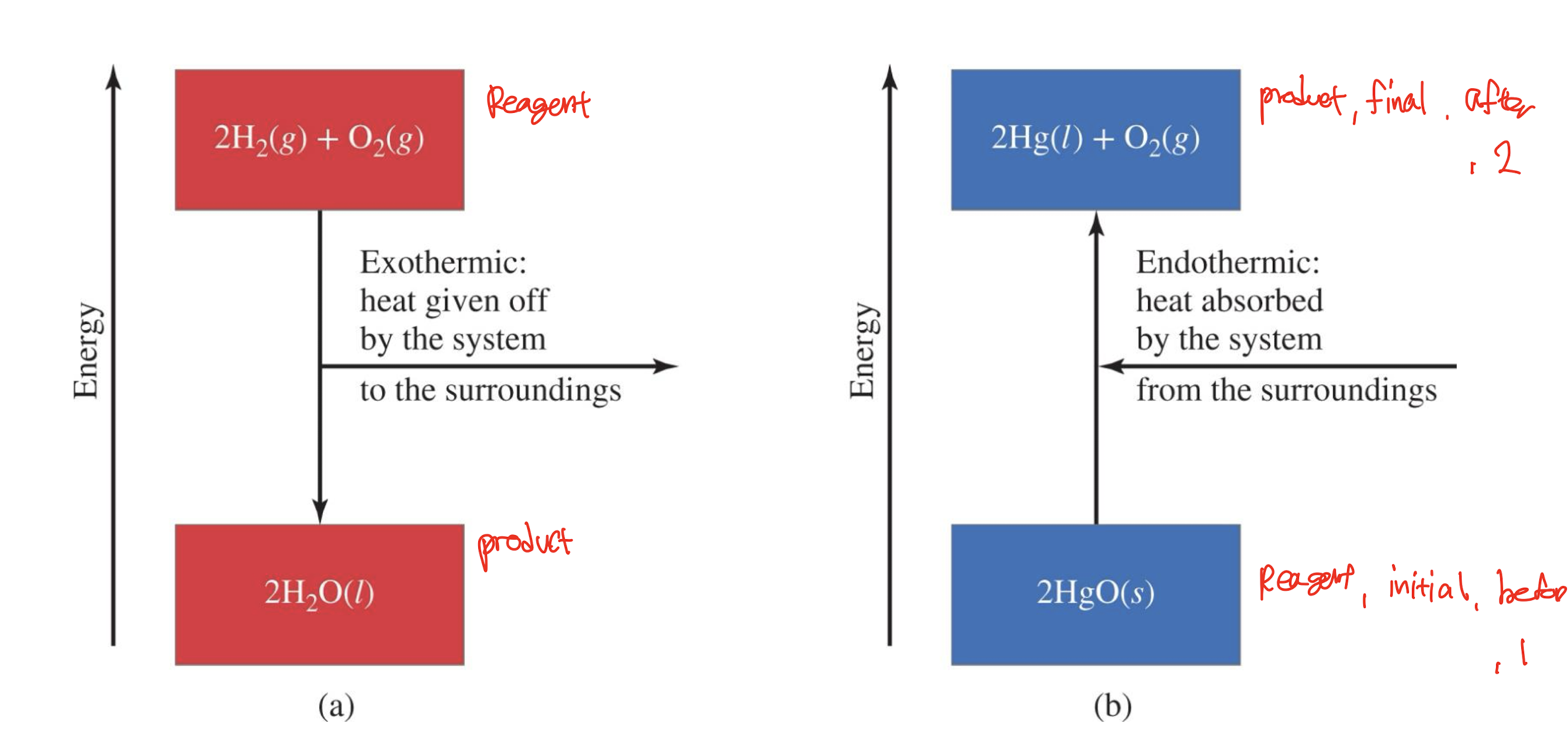
- 발열 : 시스템에서 주변으로 방출되는 열
- 에너지는 product에서 reagent로 간다.
- 흡열 : 시스템이 주변에서 흡수하는 열
- 에너지는 reaget / initail / before / 1에서 product / final / after / 2로 간다.
6.3 열역학 입문
[1] 열역학 (Thermodynamics)
: 열과 다른 종류의 에너지 상호 변환에 대한 과학적 연구이다.
1) 상태 함수 (state functions)
: 그 조건이 어떻게 달성되었는지에 관계 없이, system의 상태에 의해 결정되는 속성
2) 주 내용
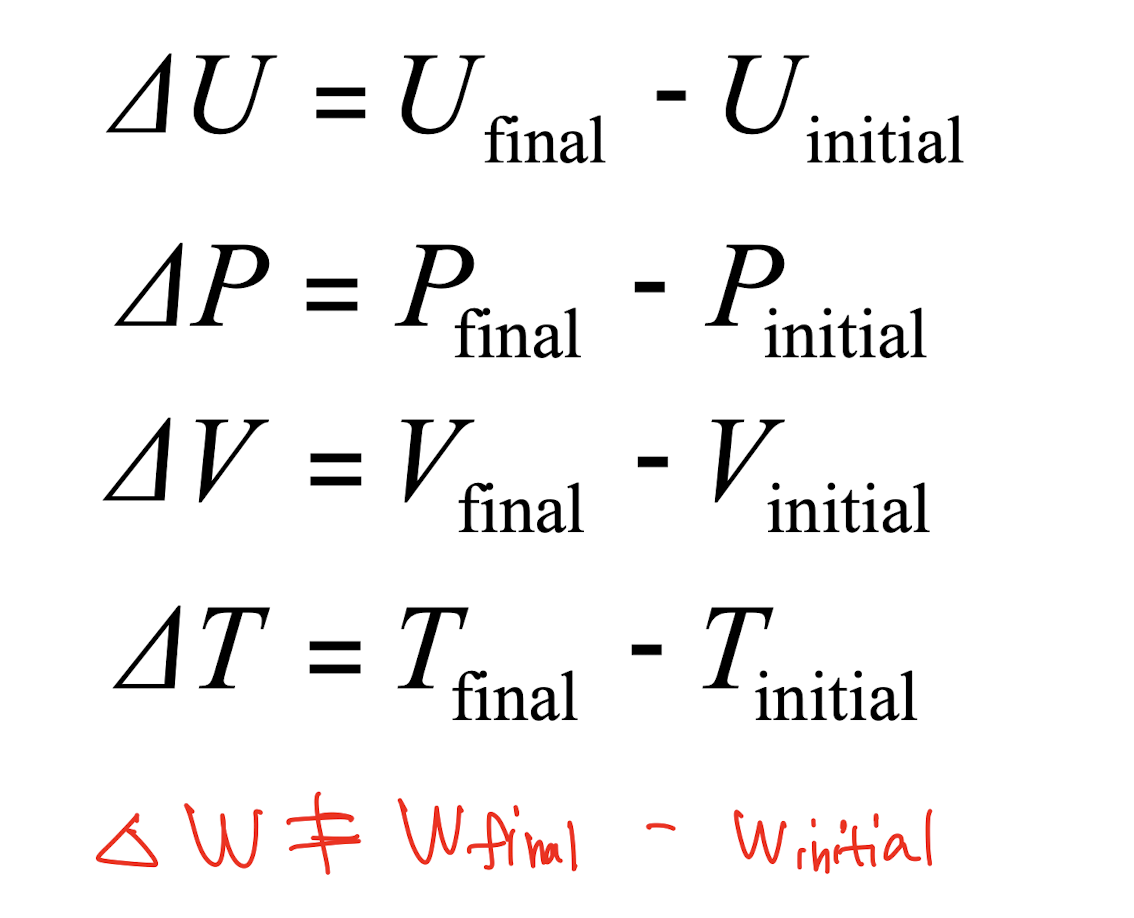
3) 예시
: 등산객 1과 등산객 2의 위치에너지는 서로 다른 경고를 택했지만, 동일하다.
[2] 열역학 제 1법칙
: 에너지는 한 형태에서 다른 형태로 변환될 수는 있지만, 생성되거나 파괴될 수는 없다.

1) 예시 : 발열 화학 반응
- 연소 시스템에 의해 손실되는 화학 에너지 (negative) = 주변에서 얻는 에너지 (positive)
[3] 첫 번째 법칙의 또 다른 형태
: $ΔU = q + w$
1) 특징
- $ΔU$ : 시스템 내부 에너지의 변화
- $q$ (Heat) : system과 주변 환경 간의 교환된 열
- w (Work) : system에서 (또는 system에 의해) 수행되는 작업
2) 공식
$w = -PΔV$
- 기체가 일정한 외부 압력에 대해 팽창할 때 발생.
3) Sign Conventins for Work and Heat
- 시스템이 주변 환경에 대해 수행하는 작업 (sign -):
: 시스템이 주변 환경에 대해 일을 할 때, 에너지가 시스템에서 외부로 나가는 것으로 간주되므로, 이 경우 에너지를 잃게 되어 부호가 마이너스(-)로 표시된다. - 주변 환경에 대한 시스템에서 수행하는 작업 (sign +):
: 시스템이 주변 환경으로부터 일을 받을 때, 에너지가 외부로부터 시스템으로 들어오는 것이므로, 이 경우 에너지를 얻는 것으로 부호가 플러스(+)로 표시된다. - 주변 환경으로부터 시스템이 흡수한 열 (흡열 과정) (sign +):
: 시스템이 주변 환경에서 열을 흡수할 때, 이 열 에너지가 시스템으로 들어가게 되어, 에너지를 얻는 것이므로 부호가 플러스(+)로 표시된다. 이는 흡열 과정이라고 한다. - 시스템이 주변 환경에 방출한 열 (발열 과정) (sign -):
: 시스템이 열을 방출하여 주변 환경으로 보내면, 시스템의 에너지가 감소하므로 부호가 마이너스(-)로 표시된다. 이는 발열 과정이라고 한다.
[4] 시스템에서의 일 (Work Done on the System)
1) 기본 공식들
- 일(Work)의 기본 정의: 일은 힘과 거리의 곱
$w = F \cdot d$ (힘 × 거리)
- F: 힘 (Force)
- d: 거리 (Distance)
- 압력-부피 일(Pressure-Volume Work)
$w = -P\Delta V$
- P: 압력 (Pressure)
- ΔV: 부피 변화 (Volume change)
- 압력-부피-힘 관계식
$P \cdot V = \frac{F}{d^2} \cdot d^3 = F \cdot d = w$
2) 부피 변화와 일의 관계
- $\Delta V > 0$: 부피가 증가할 때
- $-P\Delta V < 0$: 시스템에 의해 수행된 일이 음수
- $w_{sys} < 0$: 시스템이 수행한 일
6.4 화학 반응의 엔탈피
[1] 엔탈피와 열역학 제 1법칙
: 열역학 제 1법칙은 에너지 보존 법칙으로, 시스템의 내부 에너지 변화 $(\Delta U)$는 시스템과 주변 간의 열 교환 (q)와 시스템이 한 일 (w)의 합으로 표현된다.
- $ΔU = q + w$
- q = 엔탈피
1) 개념
- 엔탈피는 일정한 압력에서 열 변화와 관련이 있다.
- 내부 에너지 변화 (\Delta U)는 엔탈피 변화 (\Delta H)와 압력-부피 일 (PΔV)의 차로 표현된다.
2) 일정한 압력에서의 관계
열 (q)와 엔탈피 (ΔH):
- 일정한 압력에서 열의 변화 (q)는 엔탈피 변화 (ΔH)와 같다:
- $q = ΔH$
일 (w):
- 시스템이 외부 압력 (P)에 대해 부피 변화가 있을 때 수행하는 일은 다음과 같다:
- $w = -PΔV$
내부 에너지 변화 $(\Delta U)$와 엔탈피 $(ΔH)$의 관계:
- 이제 이 두 식을 결합하면 다음과 같은 관계를 얻을 수 있다:
- $\Delta U = \Delta H - PΔV$
이를 다시 정리하면, 엔탈피는 내부 에너지 변화와 압력-부피 일의 합으로 표현된다:
- $\Delta H = \Delta U + PΔV$
[2] 엔탈피
: 일정한 압력에서 발생하는 공정에서 system으로 유입되거나, 유출되는 열의 흐름을 정량화하는 데 사용된다.
$ΔH = H(products) - H (reactants)$
1) $ΔH$
: 일정한 압력에서 반응하는 동안 방출되거나 흡수되는 열
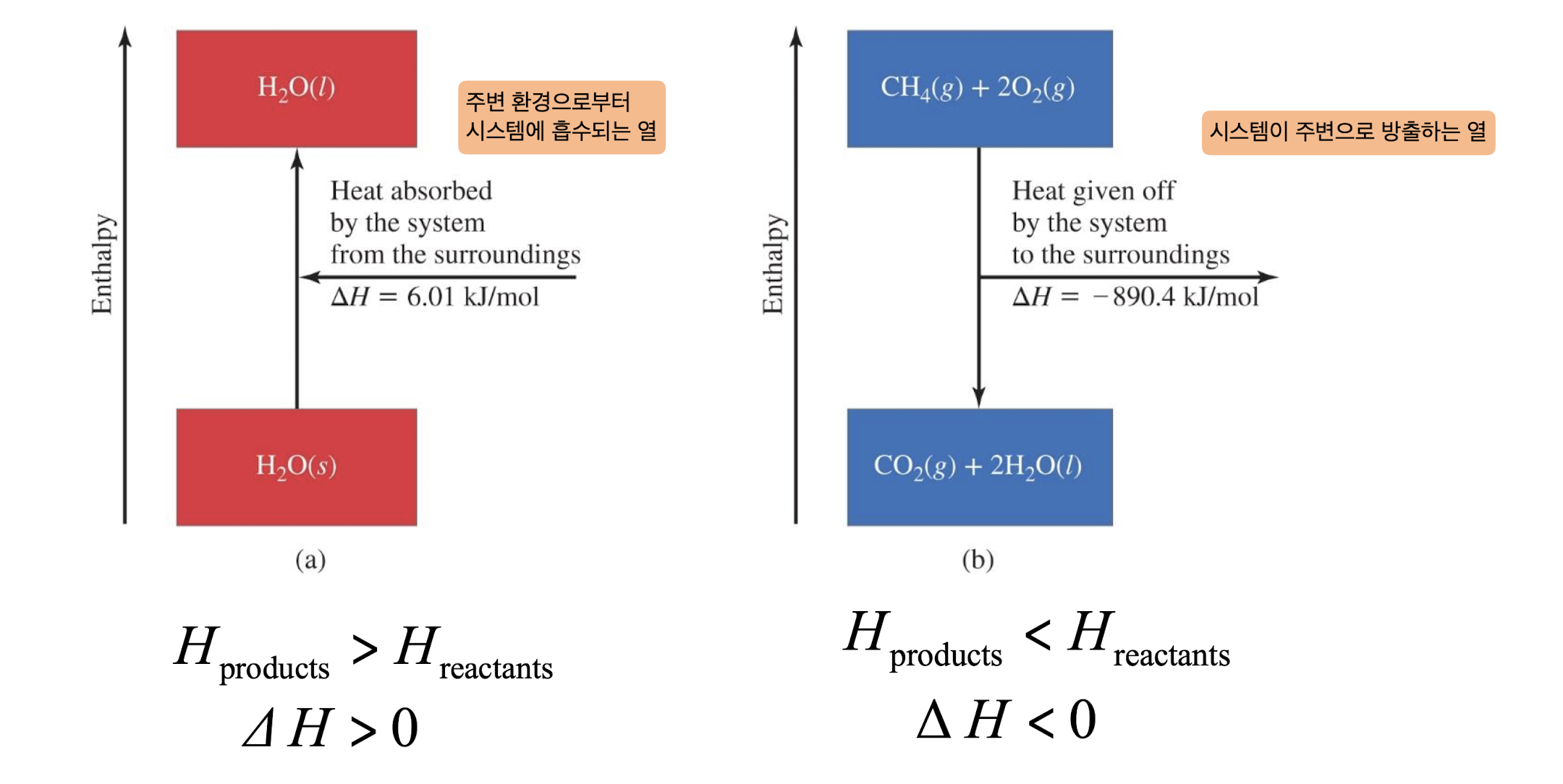
이 그림은 엔탈피 변화(ΔH)의 두 가지 대조적인 경우를 보여주고 있습니다:
- 흡열 반응의 경우 (왼쪽):
- H₂O(s) → H₂O(l) 반응
- ΔH = +6.01 kJ/mol (양수)
- H생성물 > H반응물
- 엔탈피가 증가하는 과정 (ΔH > 0)
- 시스템이 주변으로부터 열을 흡수
- 이는 얼음이 물로 녹는 과정을 보여줌
- 발열 반응의 경우 (오른쪽):
- CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(l) 반응
- ΔH = -890.4 kJ/mol (음수)
- H생성물 < H반응물
- 엔탈피가 감소하는 과정 (ΔH < 0)
- 시스템이 주변으로 열을 방출
- 이는 메탄의 연소 반응을 보여줌
[3] 열역학 표현식
- 화학량론 계수 (stoichiometric coefiicients)는 항상 물질의 몰 수를 나타낸다.
- $H_2O (s)
H_2O (l)$ - $ΔH = 6.01kJ/mol$
- 반응을 역전(reverse)시키면, H의 부호가 바뀐다.
- $H_2O (l)
H_2O (s)$ - $ΔH = -6.01kJ/mol$
- 방정식의 양변에 계수 n을 곱하면, H도 같은 계수 n만큼 변해야 한다.
- $2H_2O (s)
2H_2O (l)$ - $ΔH = 2 * 6.01 = 12.0kJ$

'한동대학교 > 일반화학' 카테고리의 다른 글
| [일반화학] Chapter 6 - (3) (0) | 2025.03.16 |
|---|---|
| [일반화학] Chapter 6 - (2) (0) | 2025.03.16 |
| [일반 화학] Chapter 5 - (2) (0) | 2025.03.14 |
| [일반 화학] Chapter 5 - (1) (0) | 2025.03.14 |
| [일반화학] Chapter 4 - (3) (0) | 2025.03.14 |





