728x90
일자 : 24-2 13주차 2차시
7.8 전자 배치 (Electron Configuration)
[1] 전자 배치 (Electron Configuration)
- 전자 배치 (Electron Configuration)란
원자의 전자가 다양한 원자 오비탈(atomic orbital)에 어떻게 분포되어 있는지를 나타낸 것이다.
1) 표현 방식
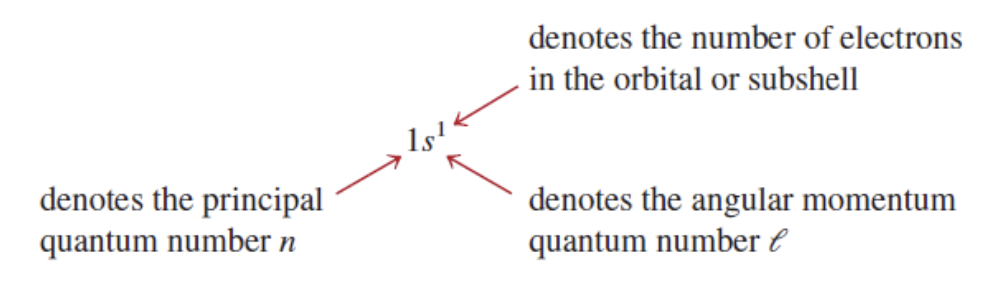
1s¹의 구성 요소:
- 1 : 주양자수(principal quantum number, n)를 나타낸다. 이는
오비탈의 에너지 수준을 의미한다. - s : 각운동량 양자수(angular momentum quantum number, ℓ)를 나타낸다. 이는
오비탈의 형태를 결정하며, s는 ℓ=0을 의미한다. - ¹ : 해당
오비탈 또는 부분 껍질(subshell)에 있는 전자의 수를 나타낸다.
2) 오비탈 다이어그램 (Orbital Diagram)
- 오비탈 다이어그램은
원자의 전자 스핀 방향을 명확히 보여주기 위해 사용된다. - 각 오비탈은 두 전자까지 수용 가능하며, 파울리 배타 원리(Pauli Exclusion Principle)에 따라 하나는 스핀 +1/2, 다른 하나는 스핀 -1/2 상태여야 한다.
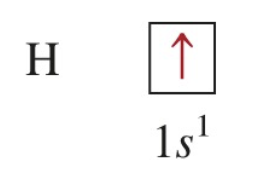
- 수소 원자(H)의 경우 오비탈 다이어그램은 상자 안에 화살표로 전자의 방향을 나타낸다.
- 상자: 오비탈을 나타낸다.
- 위쪽 화살표(↑): 전자가 스핀 양자수(spin quantum number)가 +1/2인 상태임을 의미한다.
- 1s¹: 수소의 전자는 가장 낮은 에너지 수준인 1s 오비탈에 하나 존재한다는 것을 나타낸다.
[2] Paramagnetism and Diamagnetism
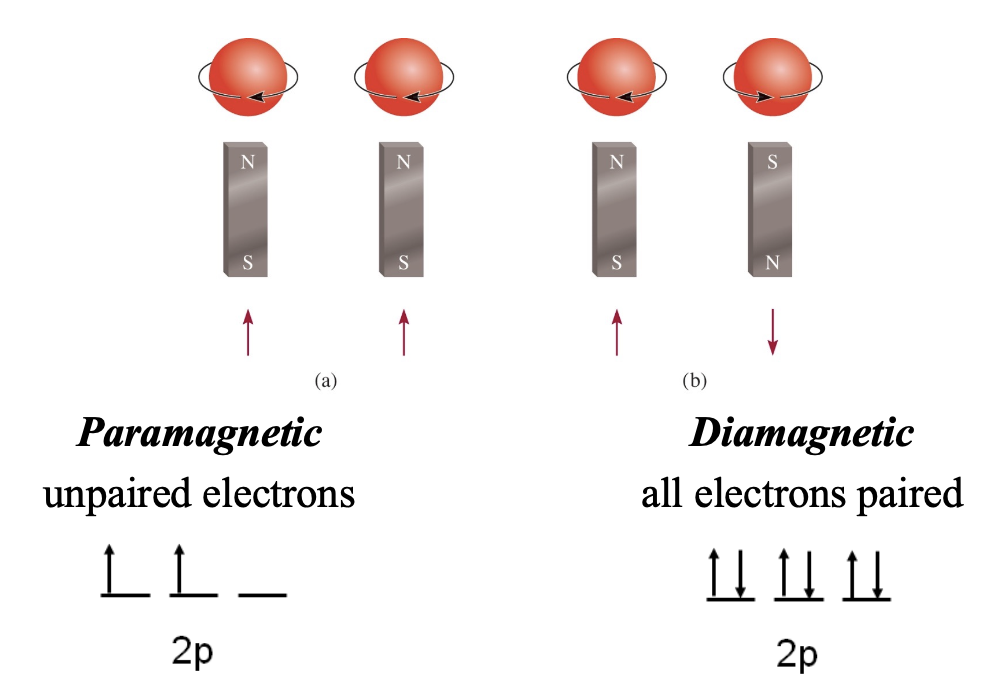
- Paramagnetic unpaired electrons
상자성(Paramagnetism)은전자가 짝을 이루지 않는 상태를 말한다.- 즉, 전자가 쌍을 지어있지 않고 홀로 존재하는 경우이다.
- Diamagnetic all electrons paired
반자성(Diamagnetism)은모든 전자가 쌍을 이루고 있는 상태를 말한다.- 전자들이 모두 짝을 이루고 있는 것이 특징이다.
7.9 전자 배치의 원리 (The Building-Up Principle)
[1] 바닥 상태 전자 배치 (Ground State Electron Configurations)
1) 원소들의 바닥 상태 전자 배치
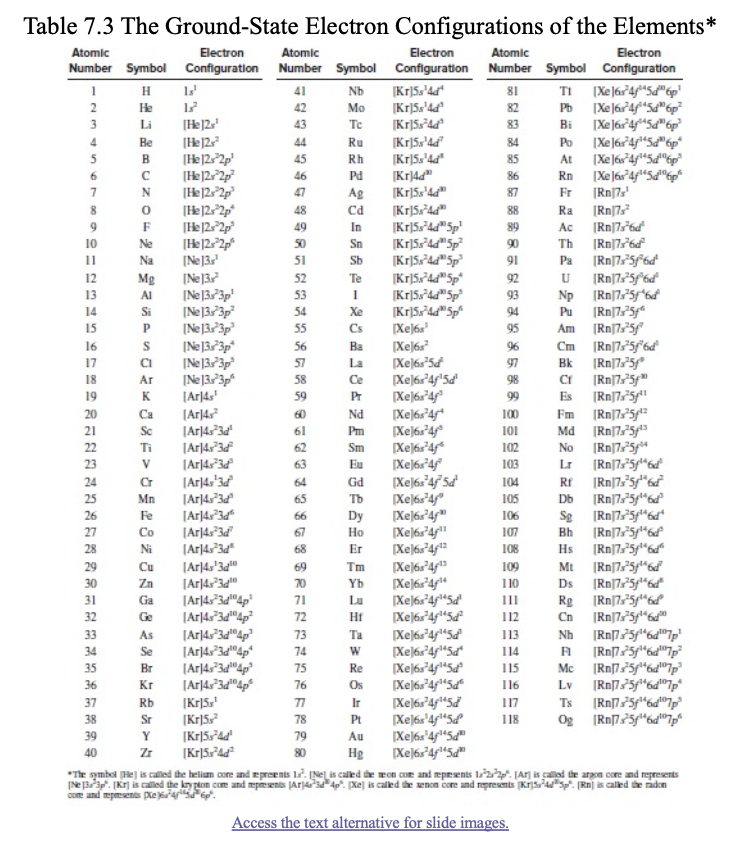
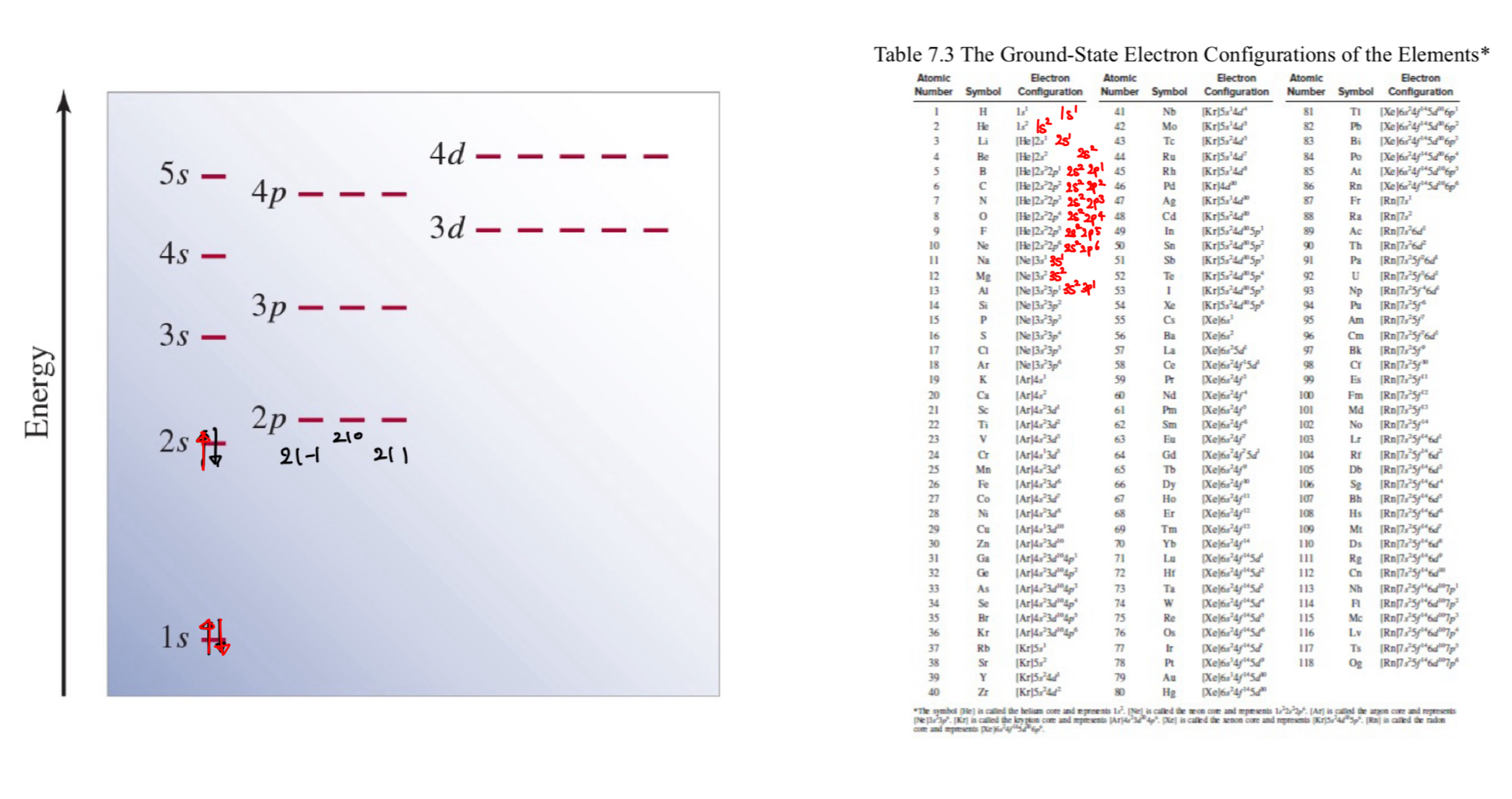
- 전자는
에너지 준위가 낮은 오비탈부터 높은 오비탈로 채워지며, 채우는 순서는 다음과 같다:**s -> p -> d**- s 오비탈: 전자는
0과 1로 표현된다. (최대 2개 수용) - p 오비탈: 전자는
0, 1, 2로 표현된다. (최대 6개 수용) - d 오비탈: 전자는
0, 1, 2, 3, 4로 표현된다. (최대 10개 수용)
- s 오비탈: 전자는
[2] 전자가 채워지는 가장 바깥 부분 껍질 (Outermost Subshell Being Filled with Electrons)
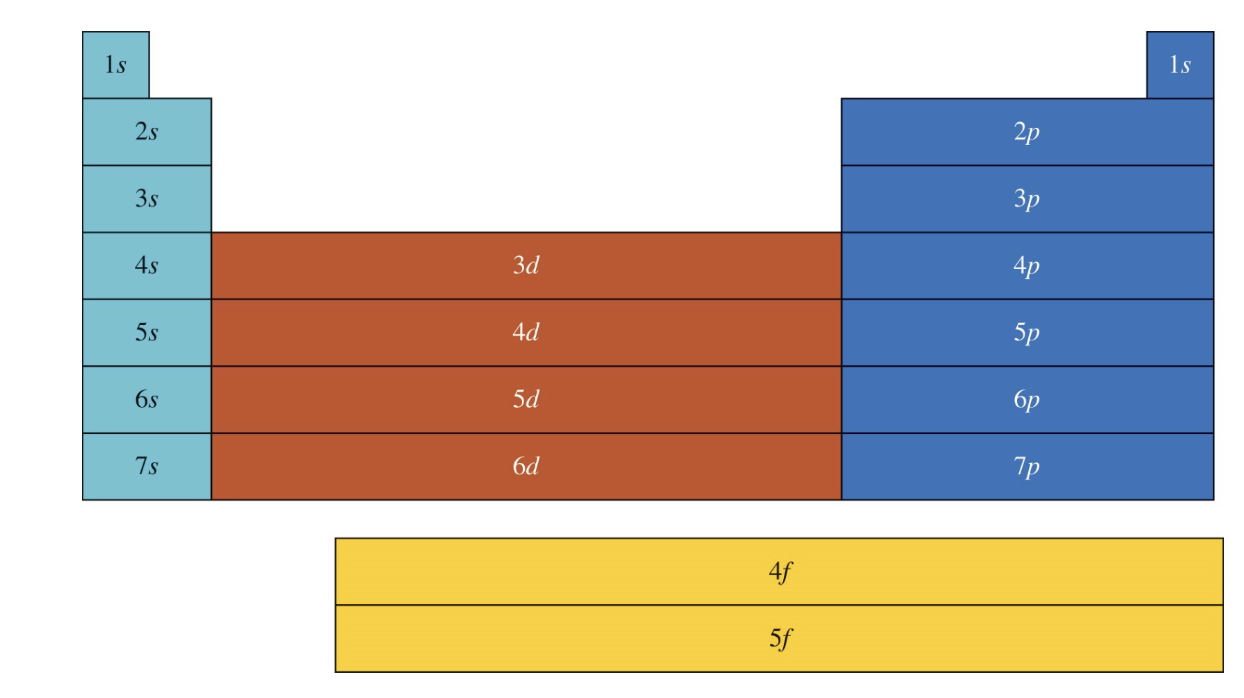
- 주기율표에서 각 원소의 위치는 가장 바깥쪽에 전자가 채워지고 있는 부분 껍질에 따라 결정된다.
- 예를 들어:
- s 껍질: 주기율표의 첫 번째와 두 번째 족에 해당하며, 최대 2개의 전자가 채워진다.
- p 껍질: 세 번째에서 여섯 번째 족에 해당하며, 최대 6개의 전자가 채워진다.
- d 껍질: 전이금속 원소들에 해당하며, 최대 10개의 전자가 채워진다.
- 예를 들어:
- 1s < 2s < 2p < 3s < 3p < 4s, 3d < 4p < 5s < 4d < 5p < 6s
1) 추가 설명
- 오프바우 원리(Aufbau Principle)에 따르면 전자는 에너지가 낮은 오비탈부터 높은 오비탈로 순차적으로 채워진다.
- 헌드의 규칙(Hund's Rule)은 동일한 에너지의 오비탈에 전자가 배치될 때, 가능한 한 전자가 홀로 분리되어 채워지게 한다는 원리를 설명한다.
- 이 배치 과정은 원자의 화학적 성질을 이해하고, 결합 특성을 예측하는 데 필수적이다.
728x90
'🏫 한동대학교 > 일반화학' 카테고리의 다른 글
| [일반 화학] Chapter 8 -(2) (0) | 2025.03.16 |
|---|---|
| [일반 화학] Chapter 8 - (1) (0) | 2025.03.16 |
| [일반화학] Chatper7 - (4) (0) | 2025.03.16 |
| [일반화학] Chatper7 - (3) (0) | 2025.03.16 |
| [일반화학] Chapter7 - (2) (0) | 2025.03.16 |
