728x90
일자 : 24-2 14주차 2차시 (2)
Chapter 9 - 화학 결합 I: 기본 개념
9.1 루이스 점 기호
[1] 원자가 전자
원자가 전자는 원자의 가장 바깥쪽 껍질에 있는 전자이다. 화학 결합에 참여하는 전자가 바로 원자가 전자이다.
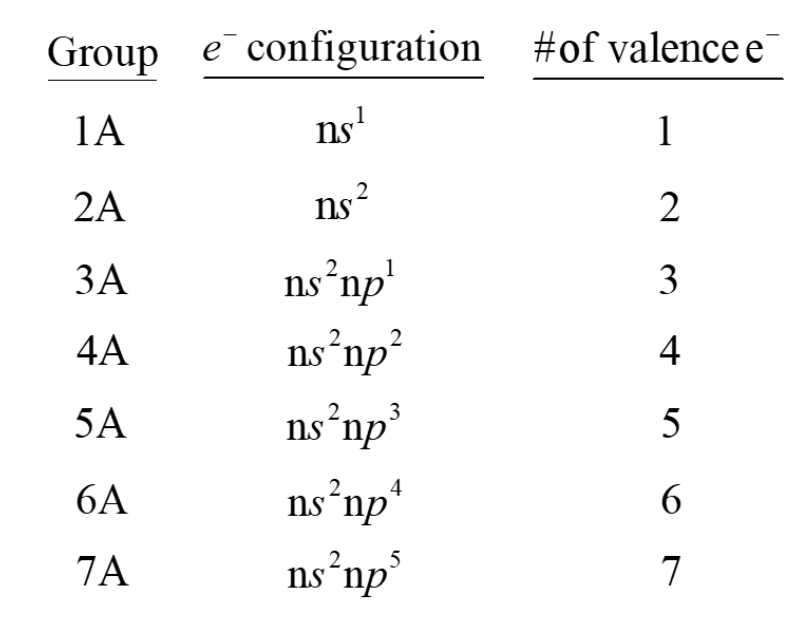
- #of valence $e^-$ : (아 뭐였더라)
[2] 대표 원소 및 비활성 기체의 루이스 점 기호
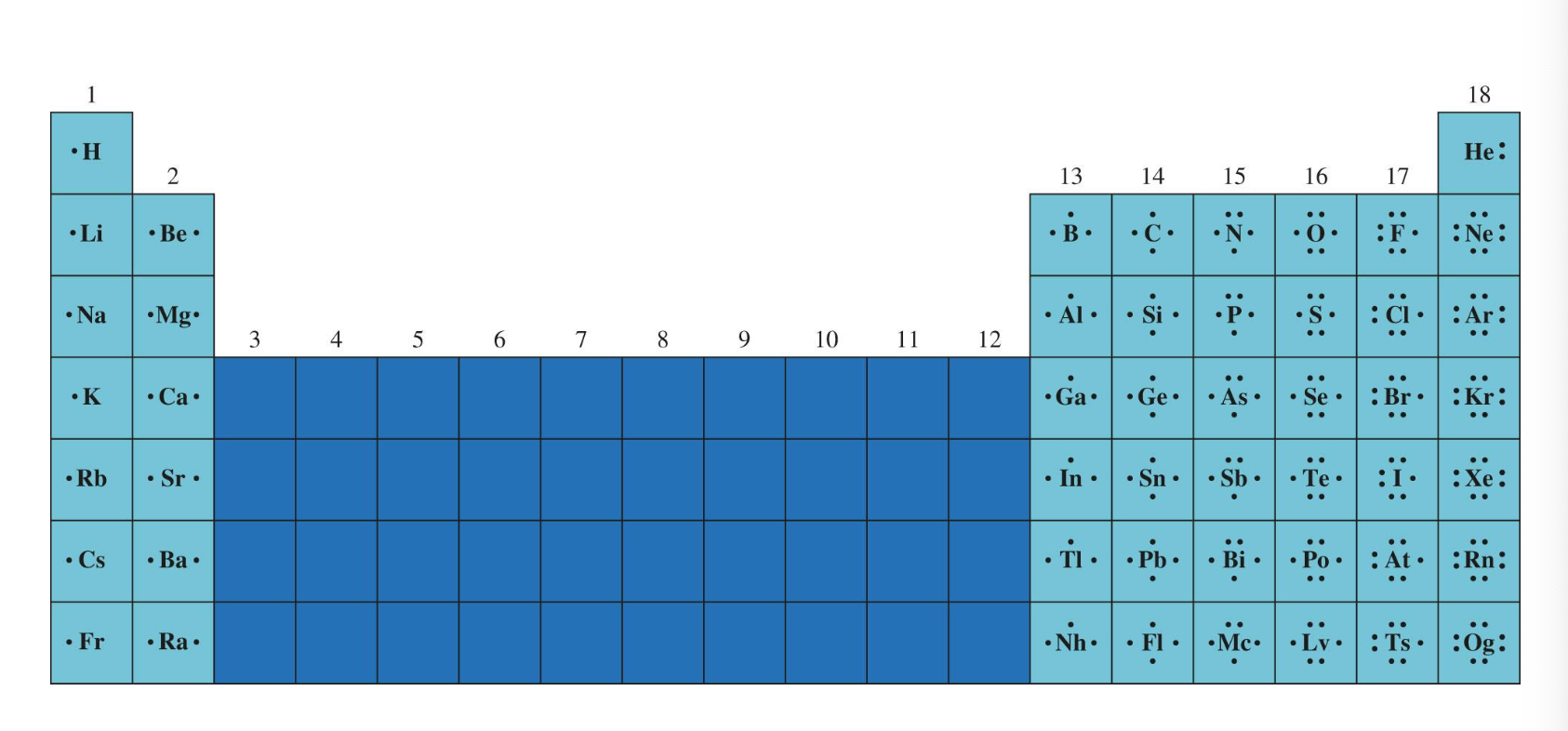
- 1행 18족을 제외한 모든 것의 점 기호는 동일하다.
9.2 이온 결합
[1] 이온 결합
이온 결합(Ionic Bond)은 이온 결합 화합물에서 이온을 결합시키는정전기적 인력(the electrostatic force)이다.
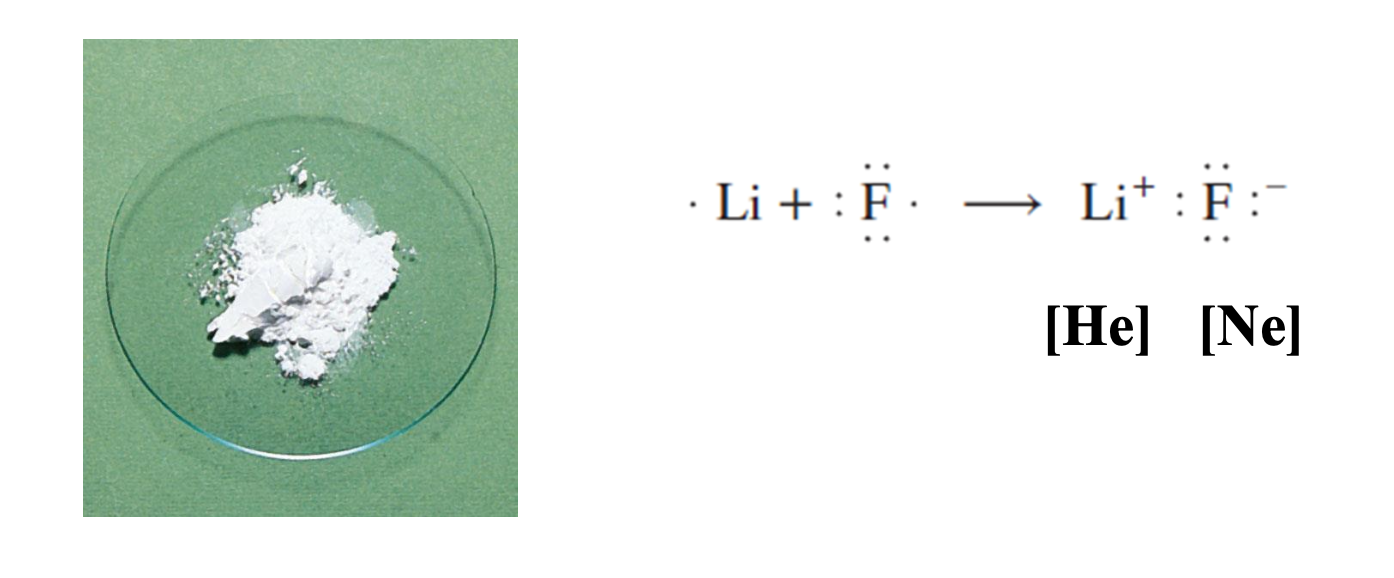
9.3 이온 화합물의 격자 에너지
[1] 정전기적 (격자) 에너지
격자 에너지(U)(Lattice enegery)는고체이온 화합물 1몰을기체상태의 이온으로완전히 분리하는 데 필요한 에너지이다.
1) 공식
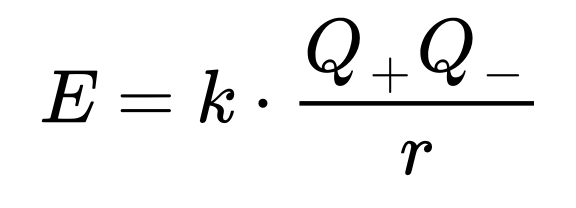
- E는 전위 에너지(Potential enegery)
- Q+는 양이온(cation)의 전하
- Q−는 음이온(aniㅌ 의 전하
- r은 이온 간의 거리
2) 예시
- 격자 에너지는 Q가 증가하거나 r이 감소할수록 증가한다.
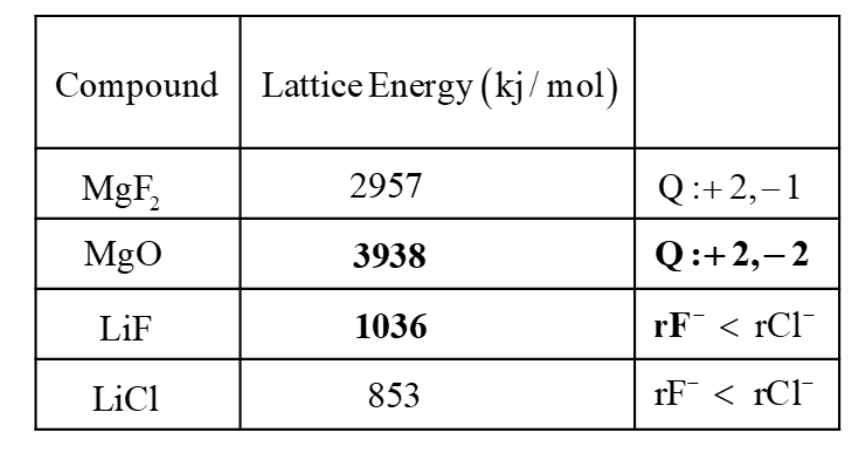
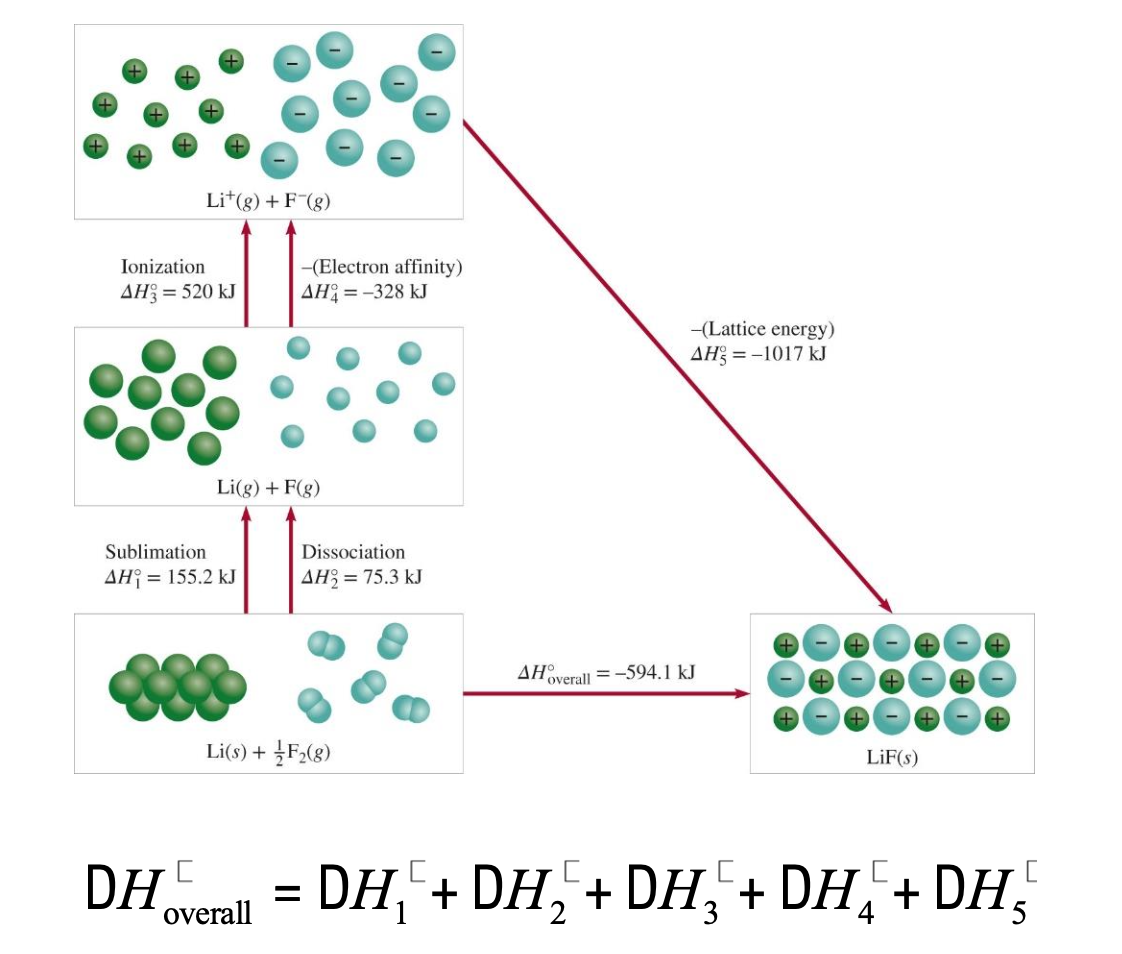
(안 배움) [2] 격자 에너지를 결정하기 위한 본-하버 주기
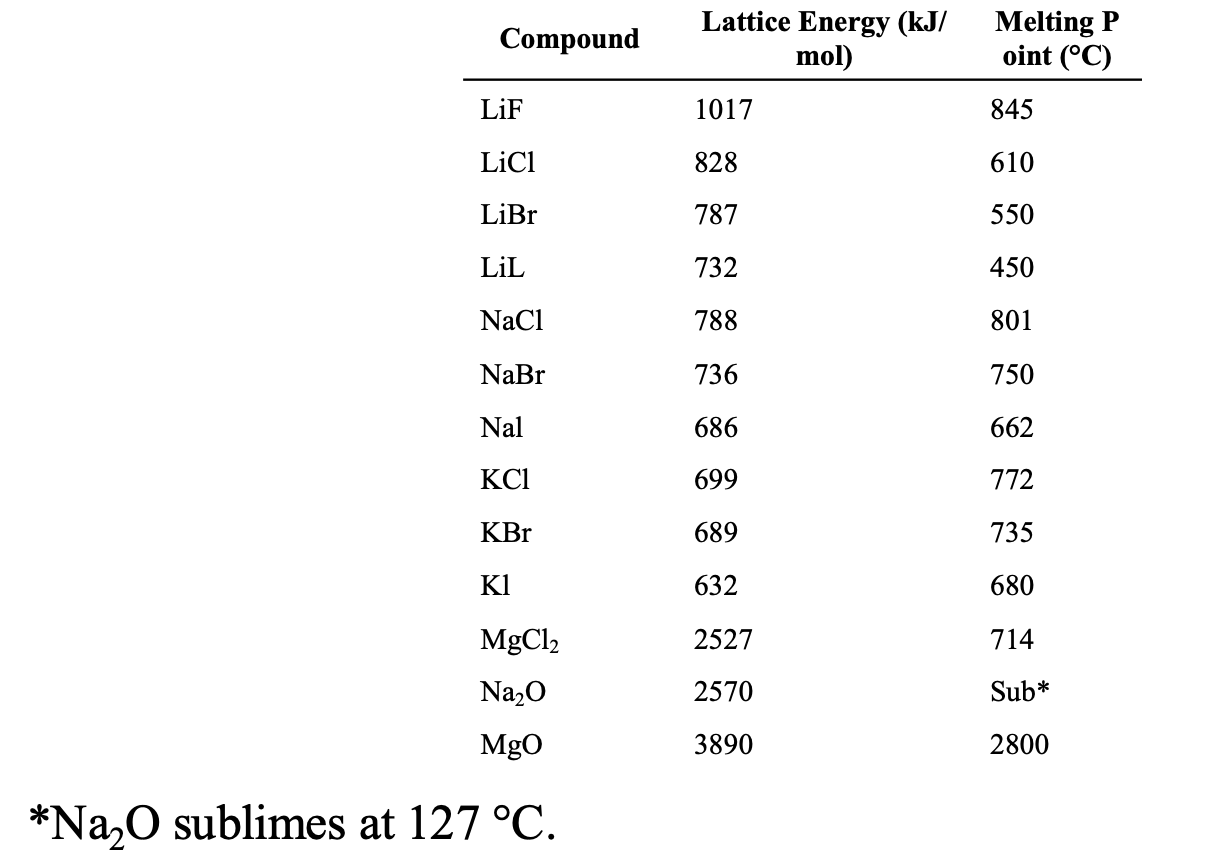
[3] 몇 가지 금속 할로겐화물과 산화물의 격자 에너지
1) 알칼리 금속 및 알칼리 토금속 할로겐화물과 산화물의 격자 에너지와 녹는점
[4] (안 배움) 실생활 속 화학
- 염화 나트륨: 일반적이고 중요한 화합물
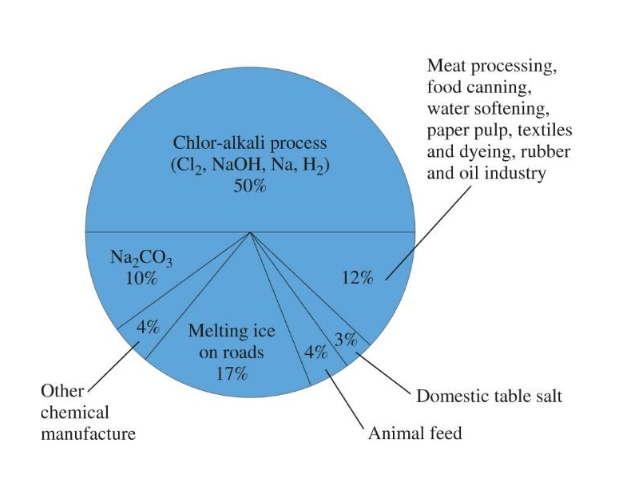
1) 예시
- 소금 채굴
- 태양 증발법을 이용한 소금 생산
[5] 9.4 공유 결합
- 공유 결합은 두 원자가 두 개 이상의 전자를 공유하는 화학 결합이다.
왜 두 원자가 전자를 공유해야 하는가?
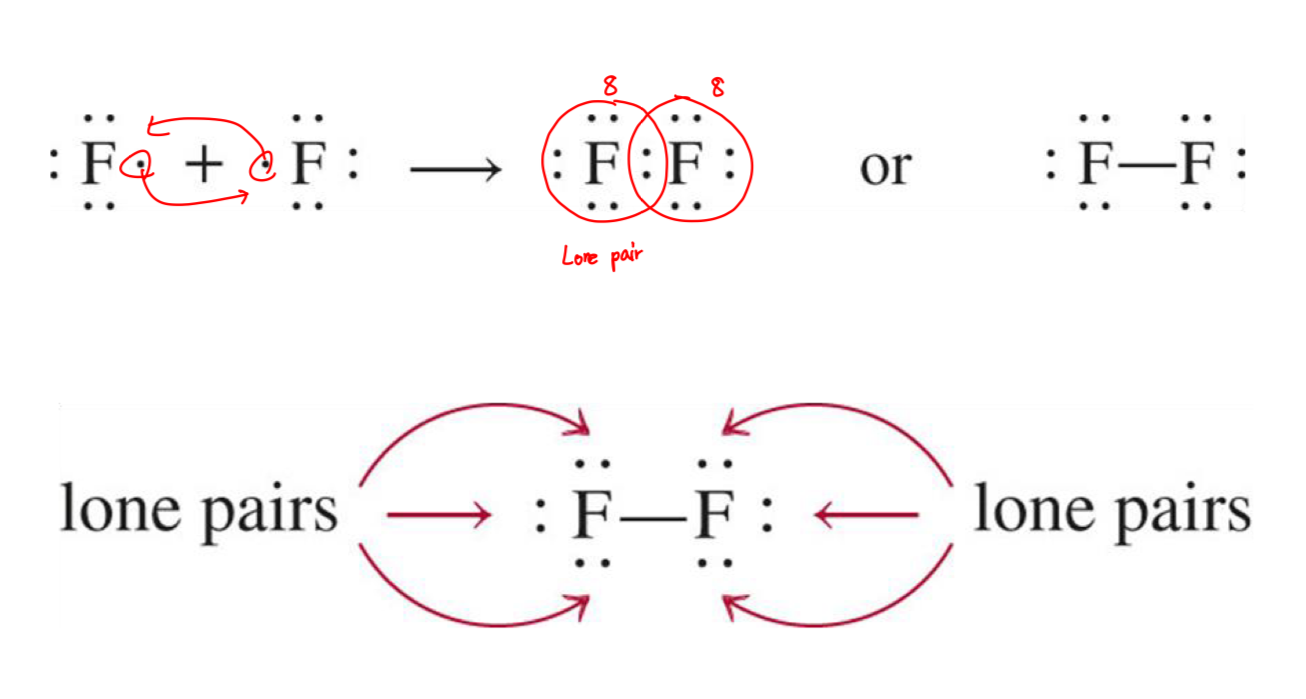
[6] 공유 결합
1) 물의 루이스 구조
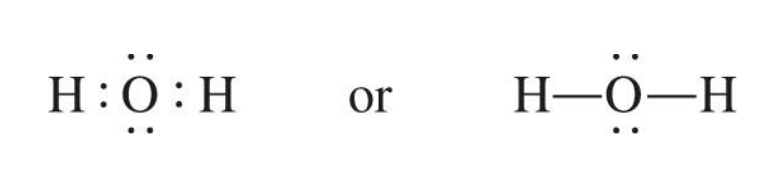
2) 이중 결합 – 두 원자가 두 쌍의 전자를 공유
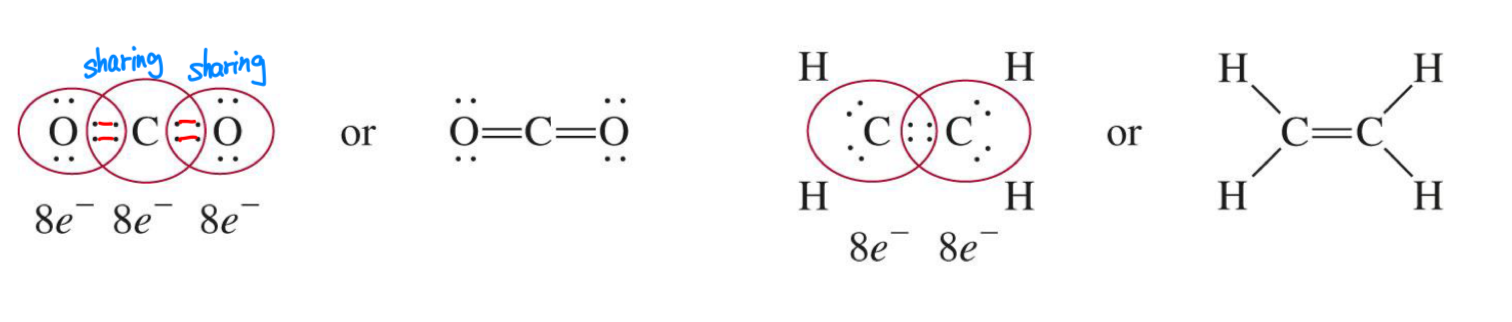
3) 삼중 결합 – 두 원자가 세 쌍의 전자를 공유

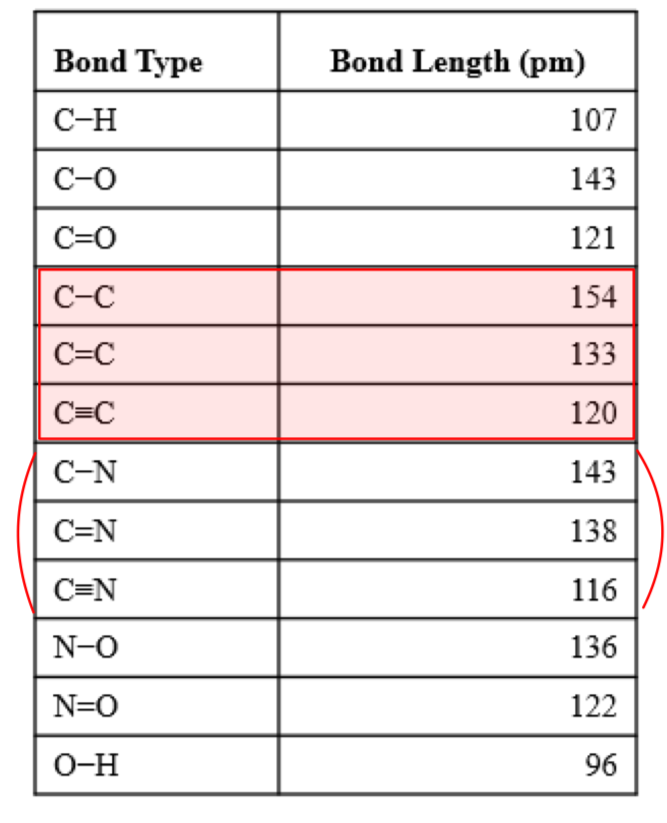
[7] 공유 결합의 길이
- 결합 길이: 삼중 결합 < 이중 결합 < 단일 결합
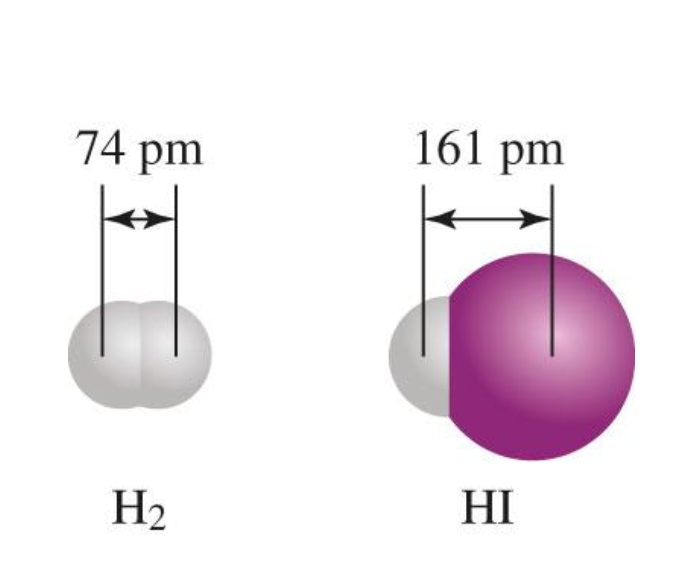
1) 일부 일반적인 단일, 이중, 삼중 결합의 평균 결합 길이
[8] NaCl과 $CCl_4$의 비교
1) 이온 화합물과 공유 화합물의 일반적 특성 비교
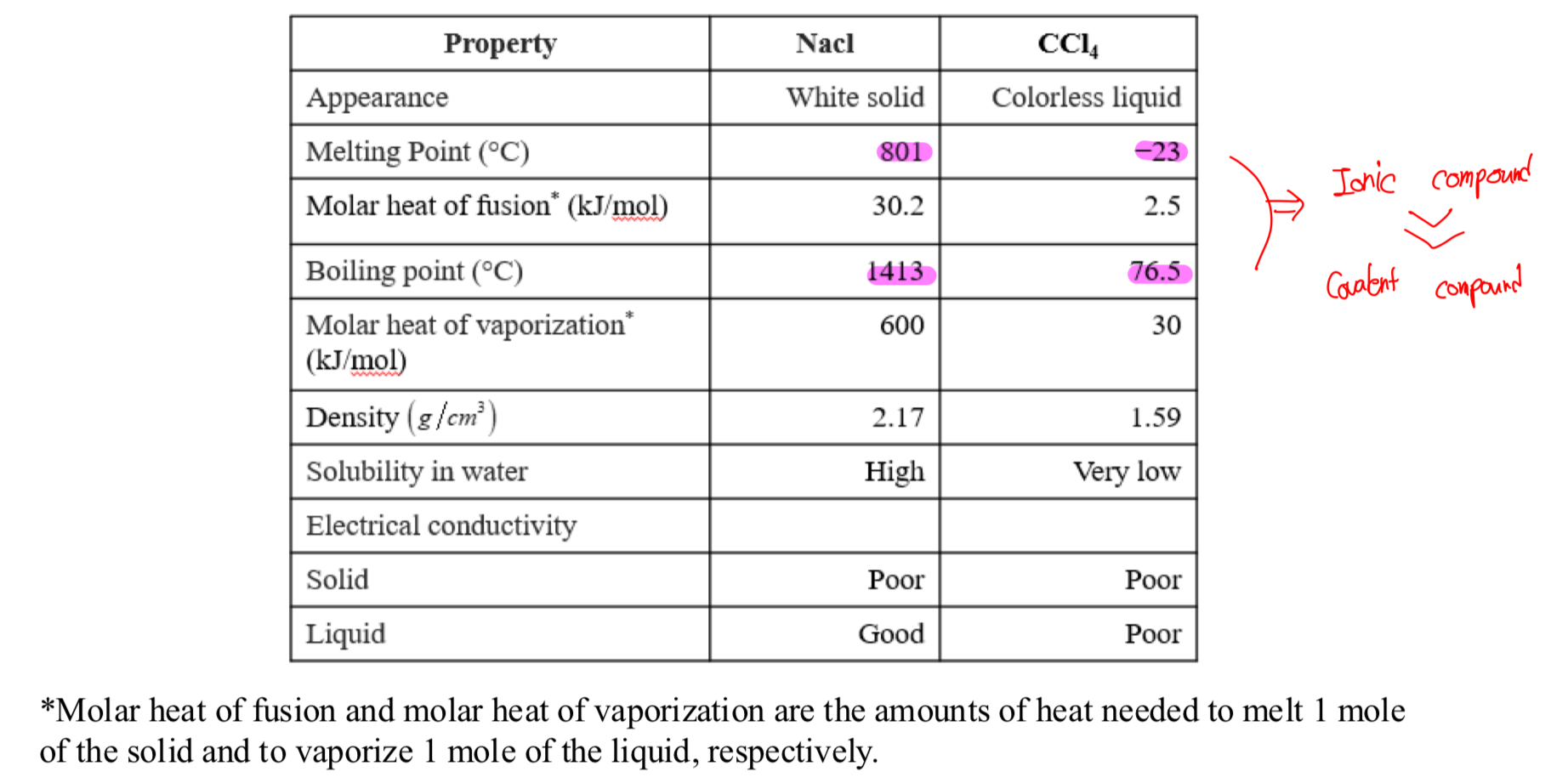
- 몰 융해열과 몰 기화열은 각각 고체 1몰을 녹이거나 액체 1몰을 기화시키는 데 필요한 열량이다.
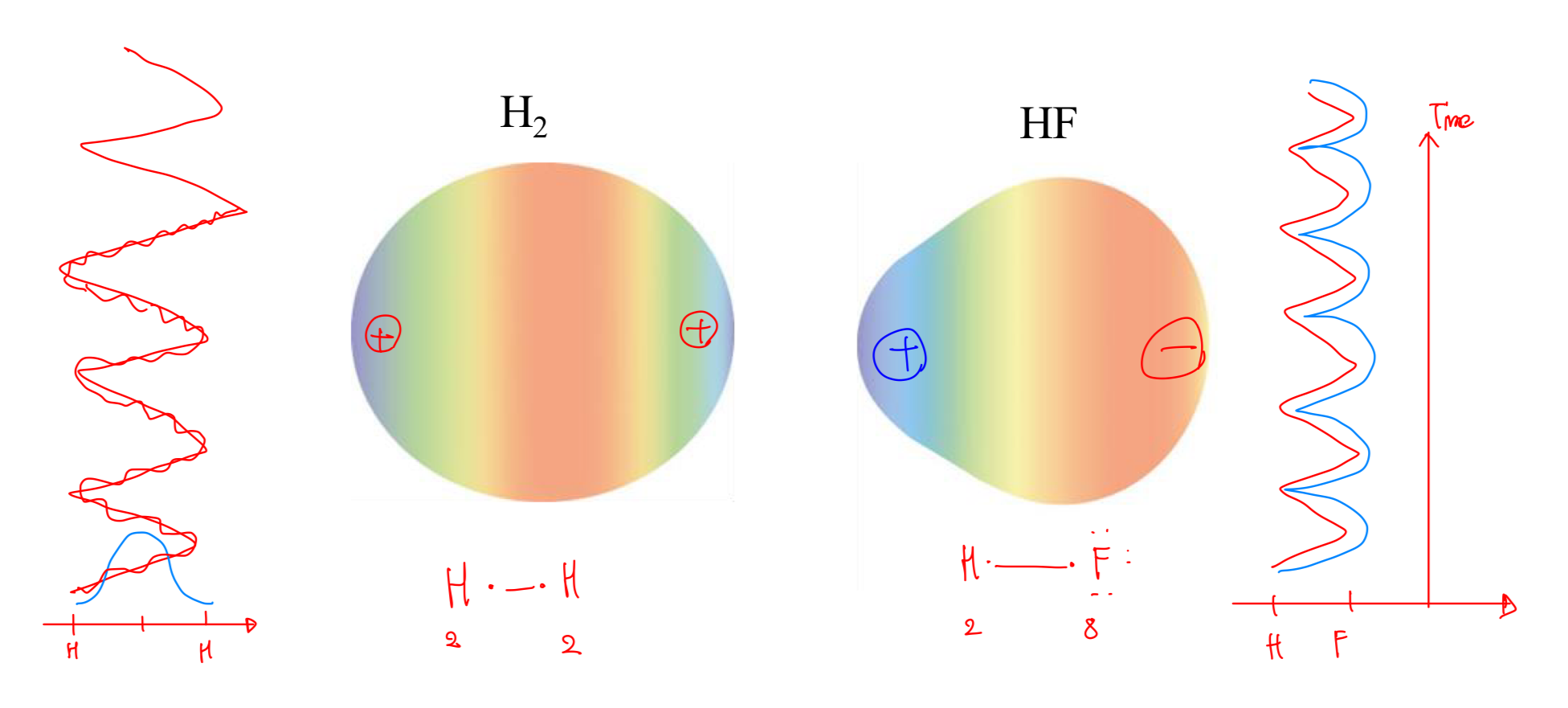
[9] 극성 공유 결합
- 극성 공유 결합 또는 극성 결합은 두 원자 중 하나에 전자 밀도가 더 높은 공유 결합이다.

728x90
'🏫 한동대학교 > 일반화학' 카테고리의 다른 글
| [일반 화학] Chapter 9 - (2) (0) | 2025.03.16 |
|---|---|
| [일반 화학] Chapter 8 -(2) (0) | 2025.03.16 |
| [일반 화학] Chapter 8 - (1) (0) | 2025.03.16 |
| [일반 화학] Chapter 7 - (5) (0) | 2025.03.16 |
| [일반화학] Chatper7 - (4) (0) | 2025.03.16 |
